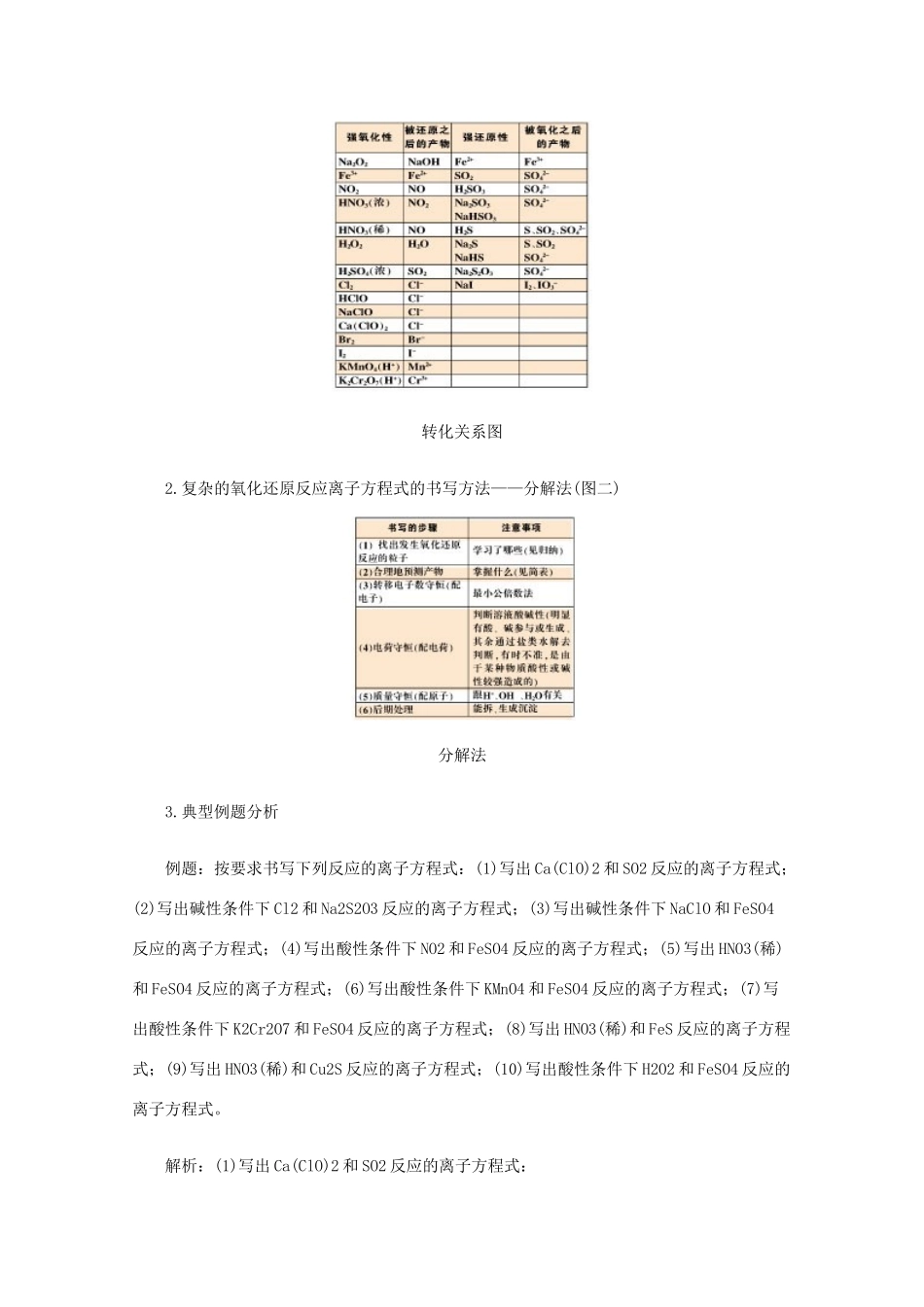
分解法写复杂氧化还原反应离子方程式高中化学涉及的反应是以氧化还原反应为主题,又经常以离子方程式的形式来体现,在高考题中经常涉及的一些复杂氧化还原反应离子方程式的书写,对于高三学生来讲往往是一道 不可逾越的墙,究竟有没有一种可行有效的方法解决这个问题呢?笔者通过对众多氧化还原反应的离子方程式书写的体验中找到了一种行之有效的方法,并把这个方法称之为分解法。 1.必须掌握的元素及其形成的具有强氧化性和强还原性的物质或离子 (1)高中新课程教材中所涉及的元素有: Na、A、Fe、Cu、Si、N、O、S、Cl、Br、I (2)元素形成具有强氧化性和强还原性的物质或离子的归纳: 强氧化性物质或离子:Na2O2、Fe3+、Fe(OH)3、Fe2O3、Fe3O4、NO、NO2、HNO3(浓)、HNO3(稀)、O2、O3、H2O2、H2SO4(浓)、Cl2、HClO、NaClO、Ca(ClO)2、Br2、I2、KMnO4(H+)、K2Cr2O7(H+) 强还原性物质或离子:Fe2+、FeO、Fe3O4、Fe(OH)2、FeS、FeS2、FeBr2、FeI2、CuS、Cu2S、Cu2O、CuH、SO2、H2SO3、Na2SO3、NaHSO3、H2S、Na2S、NaHS、Na2S2O3、NaI (3)下表是你必须掌握的转化关系:(图一)转化关系图 2.复杂的氧化还原反应离子方程式的书写方法——分解法(图二)分解法 3.典型例题分析 例题:按要求书写下列反应的离子方程式:(1)写出 Ca(ClO)2 和 SO2 反应的离子方程式;(2)写出碱性条件下 Cl2 和 Na2S2O3 反应的离子方程式;(3)写出碱性条件下 NaClO 和 FeSO4反应的离子方程式;(4)写出酸性条件下 NO2 和 FeSO4 反应的离子方程式;(5)写出 HNO3(稀)和 FeSO4 反应的离子方程式;(6)写出酸性条件下 KMnO4 和 FeSO4 反应的离子方程式;(7)写出酸性条件下 K2Cr2O7 和 FeSO4 反应的离子方程式;(8)写出 HNO3(稀)和 FeS 反应的离子方程式;(9)写出 HNO3(稀)和 Cu2S 反应的离子方程式;(10)写出酸性条件下 H2O2 和 FeSO4 反应的离子方程式。 解析:(1)写出 Ca(ClO)2 和 SO2 反应的离子方程式: 第一步:找出发生氧化还原反应的粒子:ClO-和 SO2 第二步:合理地预测产物:ClO-+SO2——Cl-+SO42- 第三步:配电子,由于 ClO-→Cl-是得到 2e-;SO2→SO42-是失去 2e-,因此,得失电子已经相等了 第四步:配电荷,实际 SO2 是被氧化为 H2SO4,写离子方程式时,H2SO4 是要拆的,因此写成 SO42-形式,因此该反应所产生的溶液是呈酸性的,用 H+来配电荷,显然是加在生成物的一边,并且得加 2 个 H+,即 ClO-+SO2——Cl-+SO42-+2H+ 第五步:配原子,反应是遵循质量守恒定律的,因此反应前后,相应原子个数要相等的,显然反应物的一边要加 1 个 H2O,即 ClO-+SO2+H2O——Cl-+SO42-+2H+。