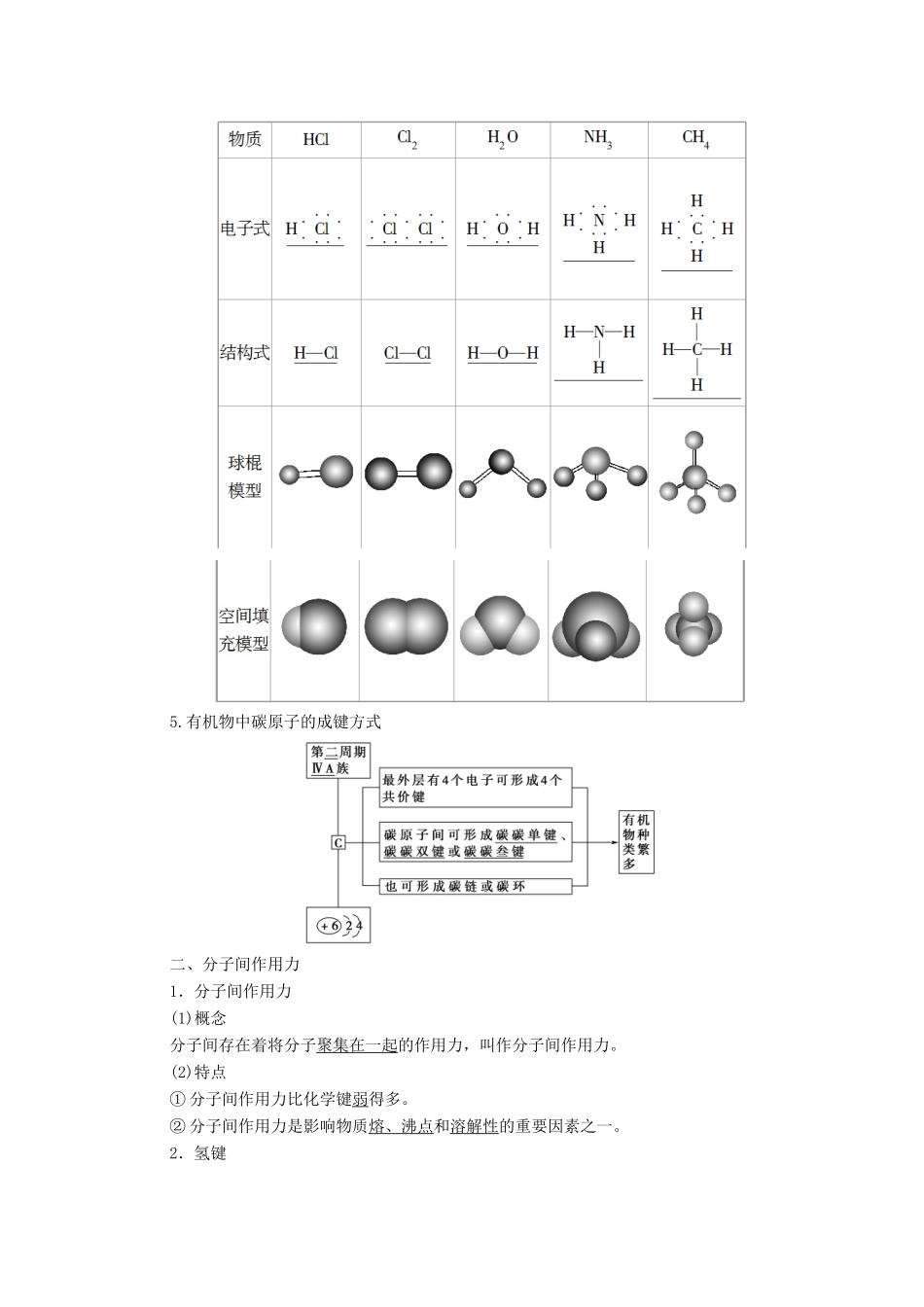
第 2 课时 共价键 分子间作用力发 展 目 标体 系 构 建1.能根据物质的微观结构,预测物质可能具有的典型特征。2.能从物质的微观结构说明同类物质的共性和不同类物质性质的差异及其原因。一、共价键与共价化合物1.共价键(1)概念:原子间通过共用电子对形成的强烈的相互作用。(2)形成过程:两种元素相互化合时,原子间共用最外层上的电子,形成共用电子对,以达到稳定的电子层结构,共用电子对同时受到两个原子核的吸引。如氯化氢的形成过程如下:2.共价分子与共价化合物(1)原子之间全部以共价键结合的分子叫作共价分子。(2)分子中直接相邻的原子之间均以共价键相结合所形成的化合物属于共价化合物,如HCl、H2O、CH4、CO2等。3.结构式用原子间的一条短线表示一对共用电子对,如 H—Cl、H—O—H 等。4.常见共价分子的表示方法5.有机物中碳原子的成键方式二、分子间作用力1.分子间作用力(1)概念分子间存在着将分子聚集在一起的作用力,叫作分子间作用力。(2)特点① 分子间作用力比化学键弱得多。② 分子间作用力是影响物质熔、沸点和溶解性的重要因素之一。2.氢键(1)像 H2O、NH3、HF 这样的分子之间存在着一种比分子间作用力稍强的相互作用,这种相互作用叫氢键。(2)氢键不是化学键,通常把氢键看作是一种较强的分子间作用力。氢键比化学键弱,比分子间作用力强。(3)分子间形成的氢键会使物质的熔点和沸点升高,对物质的溶解度有影响,如 NH3极易溶于水,主要是氨分子与水分子之间易形成氢键。1.判断正误(正确的打“√”,错误的打“×”。)(1)HCl 分子中有一对共用电子对。(√)(2)共价键只存在于共价化合物中。(×)(3)含有共价键的化合物一定是共价化合物。(×)(4)CO2的电子式为。(×)2.下列物质中既含有离子键又含有共价键的是( )A.H2O B.CaCl2C.NaOH D.Cl2C [H2O 是只含 H—O 共价键的共价化合物分子;CaCl2是离子化合物,且只含离子键;NaOH 是既含有离子键又含有共价键的离子化合物;Cl2是共价单质分子。]3.下列是中学化学常见的物质A.HCl B.NaCl C.Na2SO4 D.Na2S E.He F.N2(1)这些物质中只含共价键的是 。(2)既含离子键又含共价键的是 。(3)试写出 D、F 的电子式、F 的结构式 、 、 。[解析] HCl、N2只含共价键;NaCl、Na2S 只含离子键,Na2SO4含离子键和共价键;He无化学键。[答案] (1)A、F (2)C (3) +常见化学键类型及化合物类型的比较(素养养成——宏观辨识与微观探析)[问...