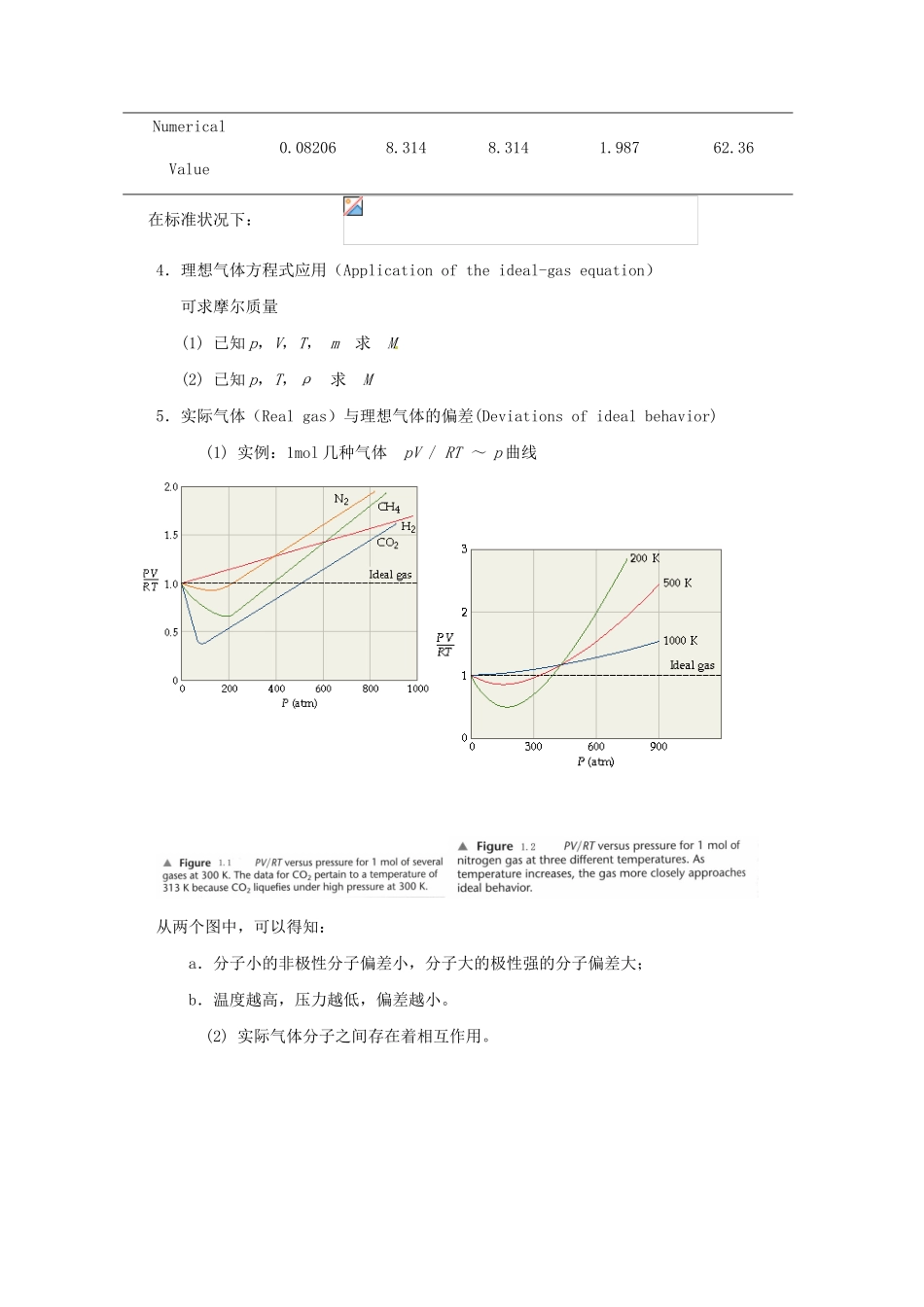
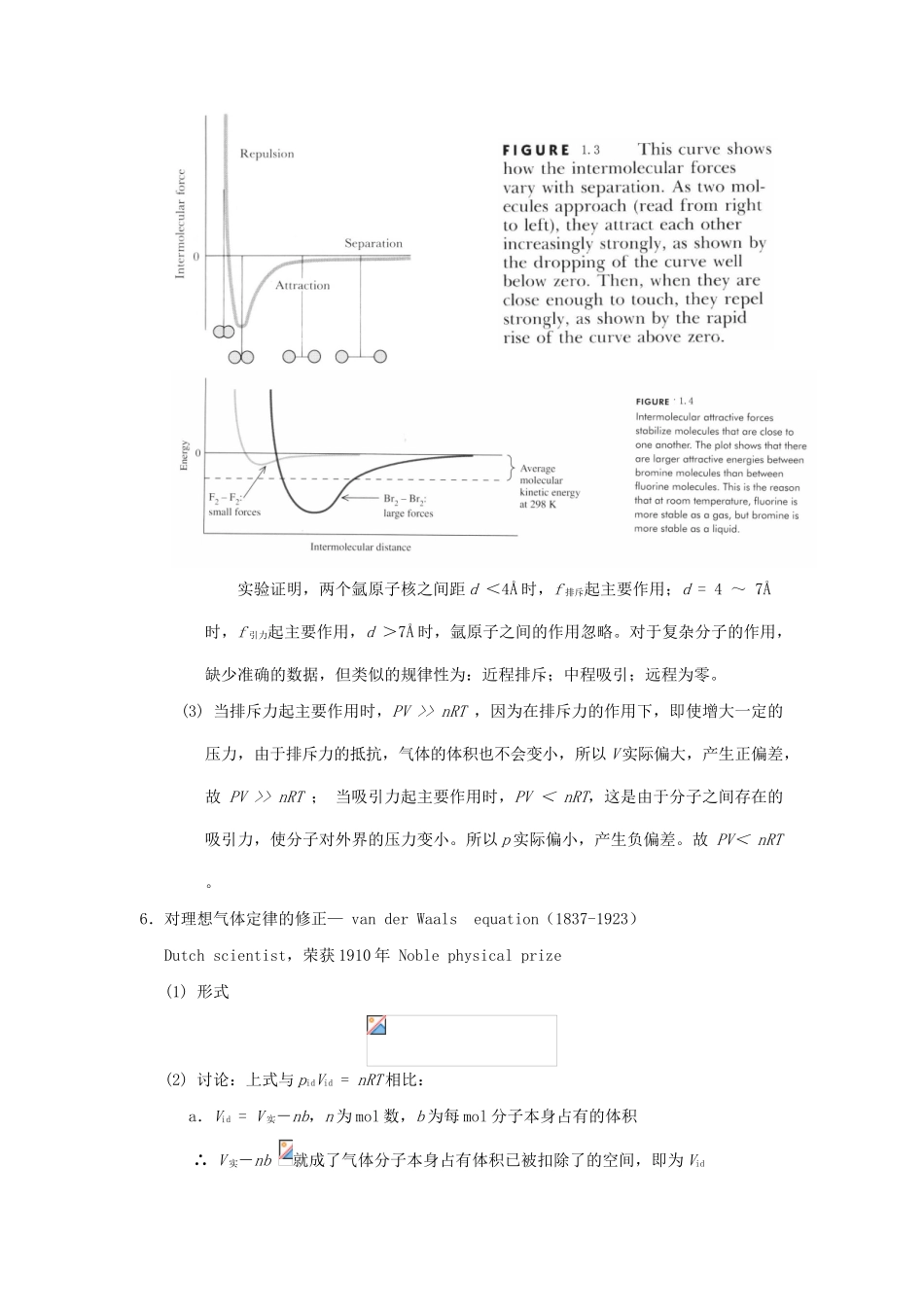
第一章 气体、液体和溶液的性质Chapter 1 The Behaviors of Gas、Liquid and Solution§1-1 气体的性质The Properties of Gases本节的重点是三个定律: 1.道尔顿分压定律(Dalton’s law of partial pressures)2.阿码加分体积定律(Amagat’s law of partial volumes)3.格拉罕姆气体扩散定律(Graham’s law of diffusion)一、理想气体(Ideal Gases)――讨论气体性质时非常有用的概念1.什么样的气体称为理想气体?气体分子间的作用力很微弱,一般可以忽略;气体分子本身所占的体积远小于气体的体积。即气体分子之间作用力可以忽略,分子本身的大小可以忽略的气体,称为理想气体。2.理想气体是一个抽象的概念,它实际上不存在,但此概念反映了实际气体在一定条件下的最一般的性质。3.实际气体在什么情况下看作理想气体呢?只有在温度高和压力无限低时,实际气体才接近于理想气体。因为在此条件下,分子间距离大大增加,平均来看作用力趋向于零,分子所占的体积也可以忽略。二、理想气体定律(The Ideal Gas Law)1.由来(1) Boyle’s law(1627-1691)British physicist and chemist - The pressure-volume relationshipn、T 不变 , V ∝ 1/ p or pV = constant(2) Charles’s law(1746-1823)French scientist1787 年发现-The temperature-volume relationshipn、p 不变 , V ∝ T or V/T = constant(3) Avogadro’s law(1778-1823)Italian physicistAvogadro’s hypothesis :Equal volumes of gases at the same temperature and pressure contain equal numbers of molecular. Avogadro’s law The volume of a gas maintained at constant temperature and pressure is directly proportional to the number of moles of the gas.T、p 不变 , V ∝ n2.理想气体方程式(The ideal-gas equation) 由上三式得:V ∝ nT / p,即 pV ∝ nT,引入比例常数 R,得:pV = nRT3.R:Gas constantUnitsl·atm·mol1·K1J·mol1·K1m3 ·Pa·mol1·K1cal·mol1·K1l·torr·mol1·K1Numerical Value0.082068.3148.3141.98762.36在标准状况下: 4.理想气体方程式应用(Application of the ideal-gas equation) 可求摩尔质量 (1) 已知 p,V,T, m 求 M (2) 已知 p...