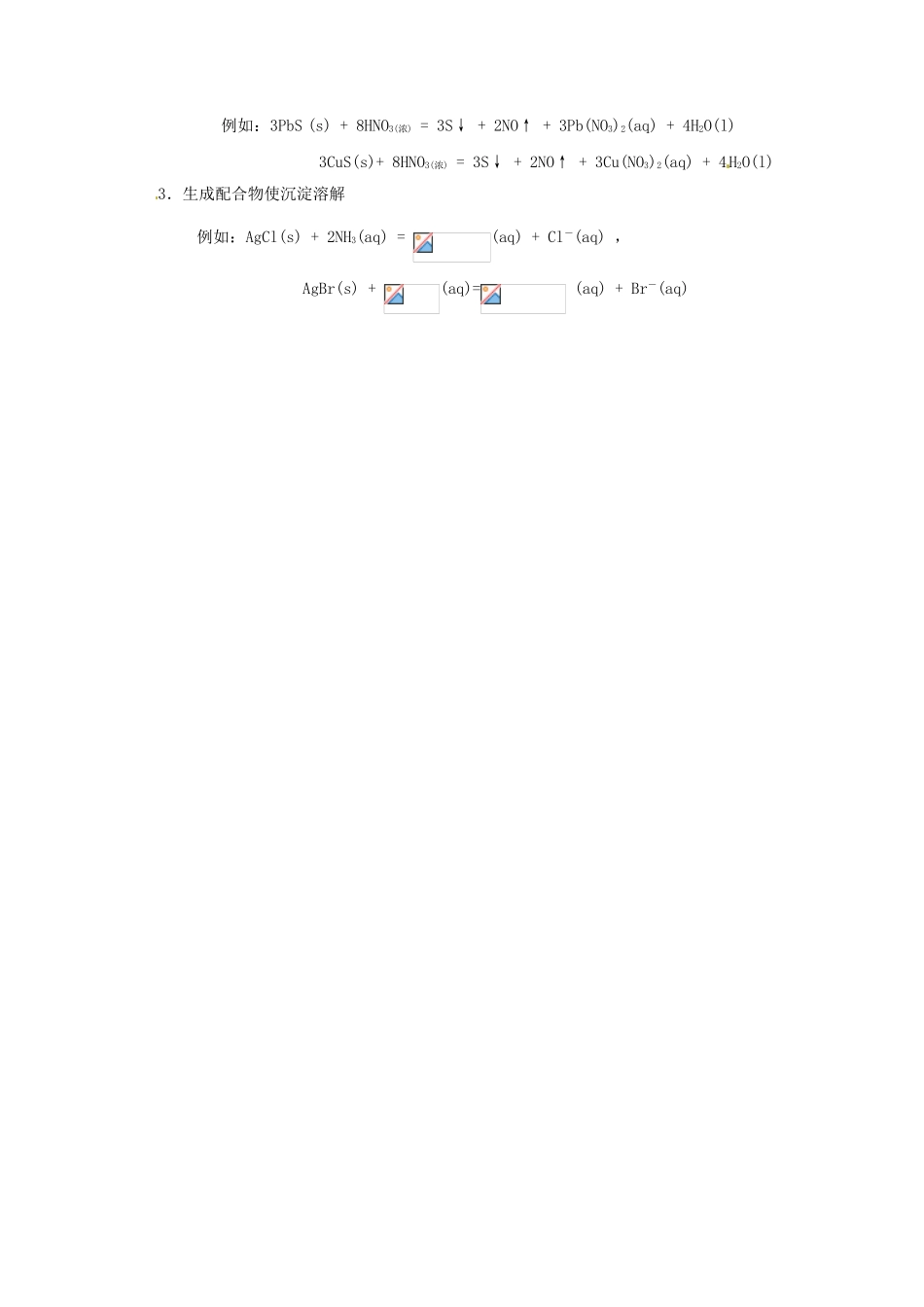
§5-2 沉淀—溶解平衡的移动Equilibrium Shift between Precipitation and Solution一、影响难溶电解质沉淀的因素(The Affect Factors on Precipitation of Undissolved Electrolytes) 1.同离子效应(Common –ion effect):难溶电解质的溶解度,因加入有共同离子的强电解质而降低的效应。Sample Exercise 1:Calculate the molar solubility of CaF2 at 25℃ in a solution containing (a) 0.0100 mol·dm3Ca(NO3)2(aq ) ; (b) 0.010 mol·dm3 NaF(aq) 。Solution:设在(a)溶液中 CaF2(s)溶解度为 x mol·dm3。 CaF2(s)CaF2+(aq) + 2F-(aq) 0.010 + x 2x (0.010 + x) · (2x)2 = 3.91011 , ∵ x<<1 , ∴ 0.010 + x ≌ 0.010解得 x = 3.1105(mol·dm3 ) (b) 设在(b)溶液中 CaF2(s)的溶解度为 y mol·dm3 CaF2(s)CaF2+(aq) + 2F-(aq) y (0.010 + 2y) y · (0.010 + 2y)2 = 3.91011 ,∵ y<<1 , ∴0.010 + 2y ≌ 0.010∴(mol·dm3) 2.盐效应(salt effect):因加入过量沉淀剂或加入其它非共同离子 的强电解质,反而使沉淀的溶解度增大,此种现象称为盐效应。 例如:PbSO4在 Na2SO4溶液中的溶解度(mol·dm3)Na2SO400.0010.010.020.040.100.20PbSO41.51042.41051.61051.41051.31051.61052.3105开始时,同离子效应起主导作用,PbSO4溶解度降低;但当 Na2SO4(aq)的浓度超过 0.04 mol·dm3时,PbSO4的溶解度又随着 Na2SO4(aq)浓度的增加而增大,这时盐效应上升为矛盾的主要方面,所以为使沉淀完全,加沉淀剂的量一般以过量 20%─50%为宜。Sample Exercise 2:将 AgNO3溶液逐滴加入含有 Cl-离子和离子的溶液中,[Cl-] = [] = 0.1 mol·dm3。问:(a) AgCl 与 Ag2CrO4哪一种先沉淀?(b) 当 Ag2CrO4开始沉淀时,溶液中 Cl-离子浓度为多少?Solution:(a) AgCl 刚沉淀时,[Ag+] = Ksp / [Cl-] = 1.8109 (mol·dm3 )Ag2CrO4刚沉淀时,[Ag+] = = 3.32106 (mol·dm3 ) 所以 AgCl 首先沉淀出来。 (b) 当溶液中刚有 Ag2CrO4沉淀时,溶液中的[Ag+] = 3.32106 (mol·dm3 ) ∴ [Cl-] = Ksp / [Ag+] = (mol·dm3 )二、沉淀溶解的方法(The Methods of Precipitation Dissolution) 1.生成弱电解质使沉淀溶解(aq) CO2(g)+ H2O(l)Sample Exercise : 已 知 :, H2CO3 的 Ka1 = 4.2107 、 Ka2 = 4.81011,试计算上述反应的平衡常数 K。Solution:这种方法称为多重平衡计算法。 2.用氧化──还原反应使沉淀溶解 例如:3PbS (s) + 8HNO3(浓) = 3S↓ + 2NO↑ + 3Pb(NO3)2(aq) + 4H2O(l) 3CuS(s)+ 8HNO3(浓) = 3S↓ + 2NO↑ + 3Cu(NO3)2(aq) + 4H2O(l) 3.生成配合物使沉淀溶解 例如:AgCl(s) + 2NH3(aq) = (aq) + Cl-(aq) , AgBr(s) + (aq)= (aq) + Br-(aq)