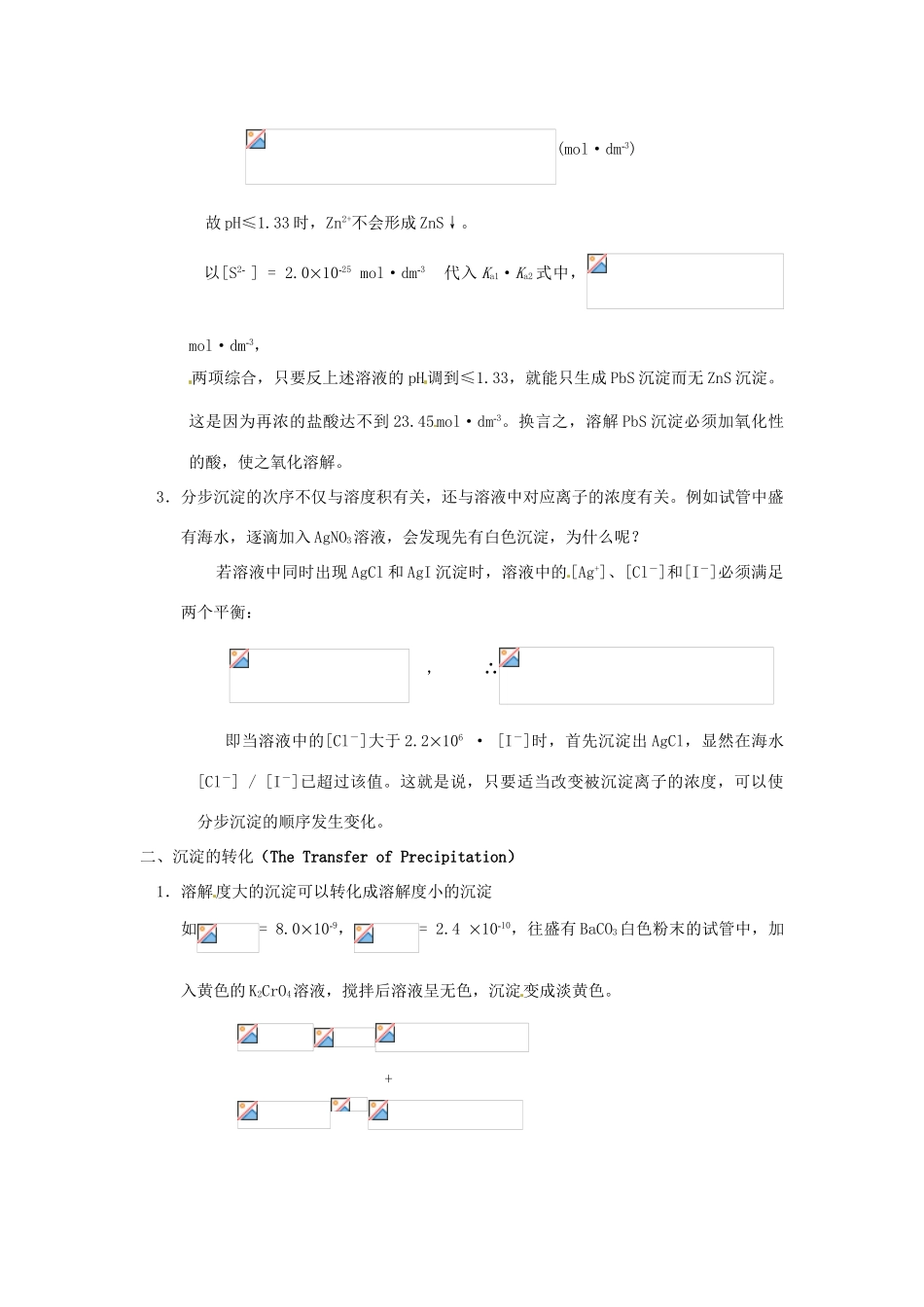
§5-3 多种沉淀之间的平衡The Simultaneous Equilibria between Precipitations一、分步沉淀(Steps of Precipitation) 1.对于同一类型的难溶电解质,在离子浓度相同或相近情况下,溶解度较小的难溶电解质首先达到溶度积而析出沉淀。例如,在 0.010mol·dm3的 I-离子和 0.010mol·dm3的 Cl-离子溶液中,逐滴加入 AgNO3溶液,先有黄色沉淀,后有白色沉淀。 2.同一类型的难溶电解质的溶度积差别越大,利用分步沉淀的方法分离难溶电解质越好。以金属硫化物为例: MnS(肉色)ZnS(白色)CdS(黄色)CuS(黑色)HgS(黑色)Ksp1.410152.510221.010298.010364.01053使沉淀溶解所需酸醋酸稀盐酸浓盐酸浓硝酸王水 ∴ [M2+] = K·[H+]2/[H2S] 所以影响难溶金属硫化物的溶解度的因素有两个方面:第一,首先取决于硫化物的溶度积大小;第二,取决于酸度。Sample Exercise:在某一溶液中,含有 Zn2+、Pb2+离子的浓度分别为 0.2mol·dm3,在室温下通入 H2S 气体,使之饱和,然后加入盐酸,控制离子浓度,问 pH 调到何值时,才能有PbS 沉淀而 Zn2+离子不会成为 ZnS 沉淀?Ksp,PbS = 4.01026,Ksp,ZnS = 1.01020Solution:已知[Zn2+] = [Pb2+] = 0.2mol·dm3 要使 PbS 沉淀,则[S2]≥K sp / [Pb2+] ∴[S2]≥2.01025 mol·dm3 要使 ZnS 不沉淀,则[S2]≤K sp / [Zn2+] ∴[S2]≤5.01020 mol·dm3 以 [S2 ] = 5.01020 mol·dm3 代入的式中, (mol·dm3)故 pH≤1.33 时,Zn2+不会形成 ZnS↓。 以[S2 ] = 2.01025 mol·dm3 代入 Ka1·Ka2 式中,mol·dm3, 两项综合,只要反上述溶液的 pH调到≤1.33,就能只生成 PbS 沉淀而无 ZnS 沉淀。这是因为再浓的盐酸达不到 23.45mol·dm3。换言之,溶解 PbS 沉淀必须加氧化性的酸,使之氧化溶解。 3.分步沉淀的次序不仅与溶度积有关,还与溶液中对应离子的浓度有关。例如试管中盛有海水,逐滴加入 AgNO3溶液,会发现先有白色沉淀,为什么呢? 若溶液中同时出现 AgCl 和 AgI 沉淀时,溶液中的 [Ag+]、[Cl-]和[I-]必须满足两个平衡: , ∴ 即当溶液中的[Cl-]大于 2.2106 · [I-]时,首先沉淀出 AgCl,显然在海水[Cl-] / [I-]已超过该值。这就是说,只要适当改变被沉淀离子的浓度,可以使分步沉淀的顺序发生变化。二、沉淀的转化(Th...