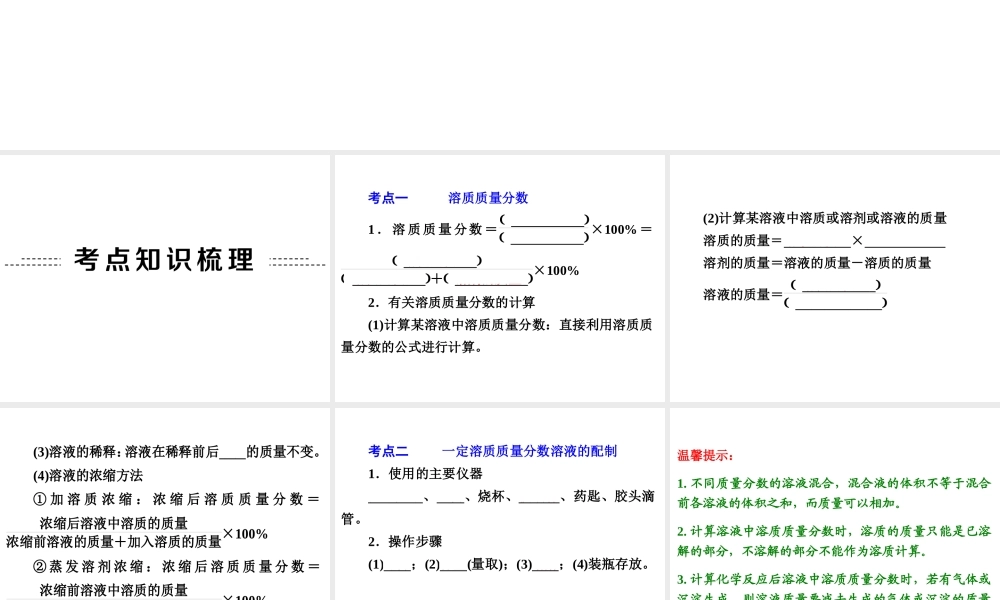
第 5 讲 溶液组成的定量表示 考点一 溶质质量分数 1 . 溶 质质 量 分数 =溶质的质量 溶液的质量 ×100% =溶质的质量 溶质的质量 +溶剂的质量 ×100% 2.有关溶质质量分数的计算 (1)计算某溶液中溶质质量分数:直接利用溶质质量分数的公式进行计算。 (2)计算某溶液中溶质或溶剂或溶液的质量 溶质的质量=溶液的质量×溶质质量分数 溶剂的质量=溶液的质量-溶质的质量 溶液的质量= 溶质的质量 溶质质量分数 (3)溶液的稀释:溶液在稀释前后溶质的质量不变。 (4)溶液的浓缩方法 ① 加 溶 质 浓 缩 : 浓 缩 后 溶 质 质 量 分 数 =浓缩后溶液中溶质的质量浓缩前溶液的质量+加入溶质的质量×100% ② 蒸 发 溶 剂 浓 缩 : 浓 缩 后 溶 质 质 量 分 数 =浓缩前溶液中溶质的质量浓缩前溶液的质量-蒸发溶剂的质量×100% 考点二 一定溶质质量分数溶液的配制 1.使用的主要仪器 托盘天平、量筒、烧杯、玻璃棒、药匙、胶头滴管。 2.操作步骤 (1)计算;(2)称量(量取);(3)溶解;(4)装瓶存放。 温馨提示:1. 不同质量分数的溶液混合,混合液的体积不等于混合前各溶液的体积之和,而质量可以相加。2. 计算溶液中溶质质量分数时,溶质的质量只能是已溶解的部分,不溶解的部分不能作为溶质计算。3. 计算化学反应后溶液中溶质质量分数时,若有气体或沉淀生成,则溶液质量要减去生成的气体或沉淀的质量。 例 1 (2013· 杭州 ) 下列关于溶液的说法正确的是 ( ) A .某温度下两种不同物质的溶液,溶质质量分数相同,则这两种物质的溶解度一定相同 B .溶质质量分数为 10% 的 200 毫升某溶液,密度为1.2 克 / 厘米 3 ,其中含溶质 24 克 C .饱和溶液析出晶体后,溶质的质量分数一定减少 D .不饱和溶液转化为饱和溶液,其溶质的质量分数一定增大 解析:溶质质量分数=溶质的质量溶液的质量×100%,两种溶液的溶质质量分数相等,溶解度可能不同,可能是由于等量的水溶解等量的溶质造成的,若是饱和溶液,则该说法成立,但不知溶液是否饱和,故 A 错误;含溶质200 毫升×1.2 克/厘米3×10%=24 克,故 B 正确;若恒温蒸发溶剂,物质的溶解度不变,则饱和溶液析出晶体后,溶质的质量分数不变,故 C 错误; 若采取降温恰好使不饱和溶液转化为饱和溶液,溶质、溶剂不变,则溶质的质量分数不变,故...