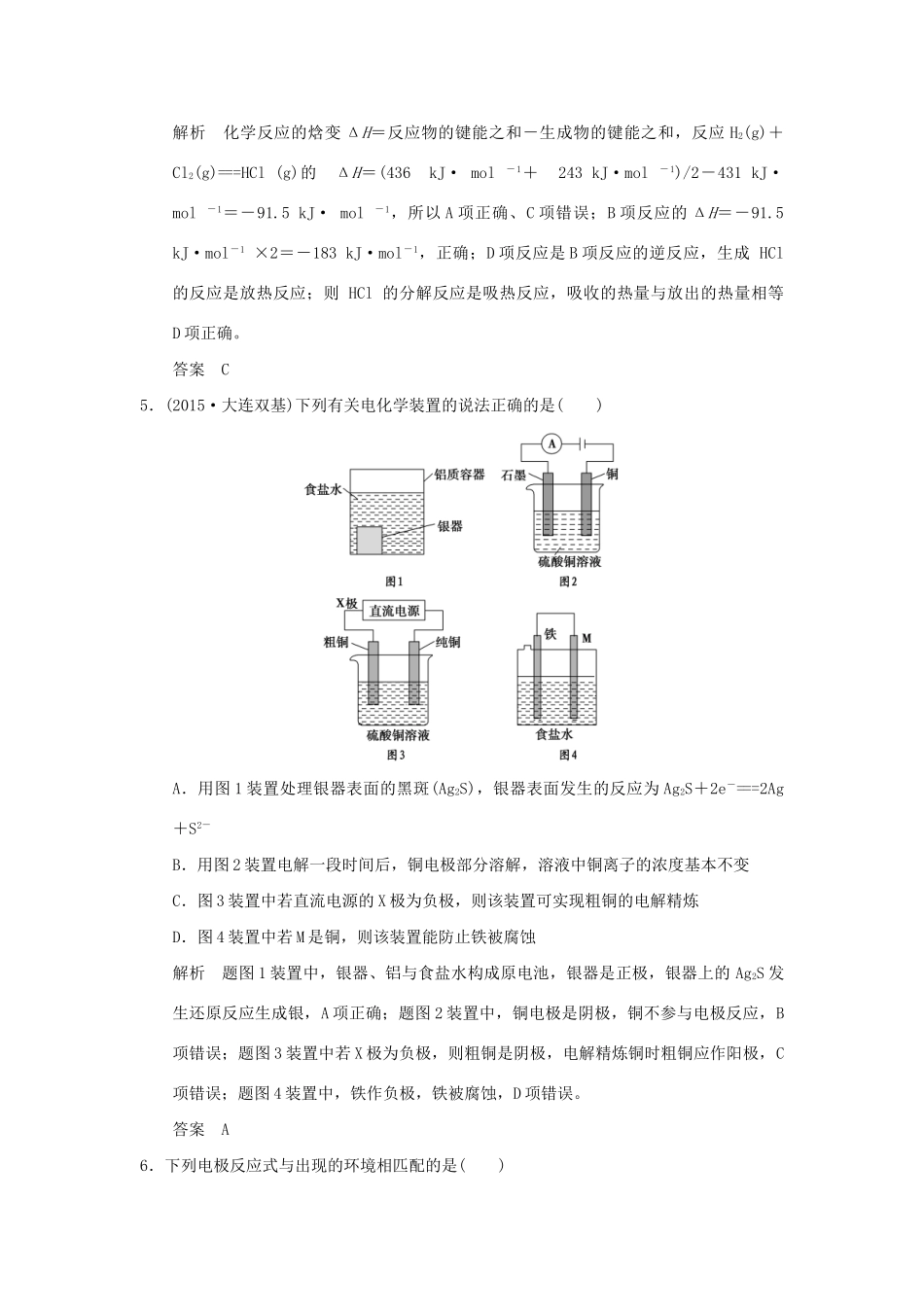
专题课时4新型化学电源(教师用书独具)一、选择题1.(2015·海淀期末)下列与金属腐蚀有关的说法中,不正确的是()A.钢铁在潮湿空气中生锈属于电化学腐蚀B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀C.金属腐蚀的本质是金属原子失去电子被氧化D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应解析钢铁中含有碳,在潮湿的空气中易形成Fe-C原电池而被腐蚀,A项正确;金属在酸性较强的环境中发生析氢腐蚀,在酸性极弱或中性环境中发生吸氧腐蚀,析氢腐蚀和吸氧腐蚀都属于电化学腐蚀,B项正确;金属被腐蚀的本质是金属原子失去电子被氧化,C项正确;铝具有很强的抗腐蚀能力是因为铝的表面易形成一层致密的氧化物薄膜,从而阻止了铝进一步被氧化,D项错误。答案D2.(2015·山东青岛一模,14)以下关于如图说法正确的是()A.如图表明催化剂可以改变反应的热效应B.如图表示某反应能量的变化与生成物状态无关C.如图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化D.如图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒解析A项,催化剂不能改变反应的热效应,只能改变反应的活化能,错误;B项,反应能量的变化与生成物状态及量都有关系,错误;C项,图中表示的是放热反应,错误;D项,图中表明化学反应不仅遵循质量守恒定律,也遵循能量守恒,正确。答案D3.下列说法正确的是()A.右图可表示水分解过程中的能量变化B.同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH不同C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)ΔH=-akJ·mol-1,Ⅱ:且a、b、c均大于零,则断开1molH—Cl键所需的能量为(a+b+c)kJ解析A项,水分解过程是吸热反应,使用催化剂会降低活化能,正确;B项,ΔH只与反应的始态和终态有关,而与反应条件和路径无关,错误;C项,加热与吸热、放热反应无关,如金属的燃烧多数需要加热,错误;D项,断开1molH—Cl键所需的能量为kJ,错误。答案A4.化学反应的本质是旧化学键的断裂和新化学键的形成。已知某些化学键的键能数据如下:化学键H—HCl—ClH—Cl键能/(kJ·mol-1)436243431则下列热化学方程式不正确的是()A.H2(g)+Cl2(g)===HCl(g)ΔH=-91.5kJ·mol-1B.H2(g)+Cl2(g)===2HCl(g)ΔH=-183kJ·mol-1C.H2(g)+Cl2(g)===HCl(g)ΔH=+91.5kJ·mol-1D.2HCl(g)===H2(g)+Cl2(g)ΔH=+183kJ·mol-1解析化学反应的焓变ΔH=反应物的键能之和-生成物的键能之和,反应H2(g)+Cl2(g)===HCl(g)的ΔH=(436kJ·mol-1+243kJ·mol-1)/2-431kJ·mol-1=-91.5kJ·mol-1,所以A项正确、C项错误;B项反应的ΔH=-91.5kJ·mol-1×2=-183kJ·mol-1,正确;D项反应是B项反应的逆反应,生成HCl的反应是放热反应;则HCl的分解反应是吸热反应,吸收的热量与放出的热量相等D项正确。答案C5.(2015·大连双基)下列有关电化学装置的说法正确的是()A.用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-===2Ag+S2-B.用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变C.图3装置中若直流电源的X极为负极,则该装置可实现粗铜的电解精炼D.图4装置中若M是铜,则该装置能防止铁被腐蚀解析题图1装置中,银器、铝与食盐水构成原电池,银器是正极,银器上的Ag2S发生还原反应生成银,A项正确;题图2装置中,铜电极是阴极,铜不参与电极反应,B项错误;题图3装置中若X极为负极,则粗铜是阴极,电解精炼铜时粗铜应作阳极,C项错误;题图4装置中,铁作负极,铁被腐蚀,D项错误。答案A6.下列电极反应式与出现的环境相匹配的是()选项电极反应式出现的环境AO2+2H2O+4e-===4OH-碱性环境下氢氧燃料电池的负极反应B4OH--4e-===O2↑+2H2O弱酸性环境下钢铁的吸氧腐蚀CCu-2e-===Cu2+粗铜精炼的阳极主要发生的反应DH2-2e-===2H+用惰性电极电解H2SO4溶液的阳极反应解析所给电极反应式为正极反应式,A项错误;在弱酸性环境下,钢铁主要发生析氢腐蚀,B项错误;用惰性电极电解H2SO4溶液的阳极反应为2H2O-4e-===4H++O2↑...