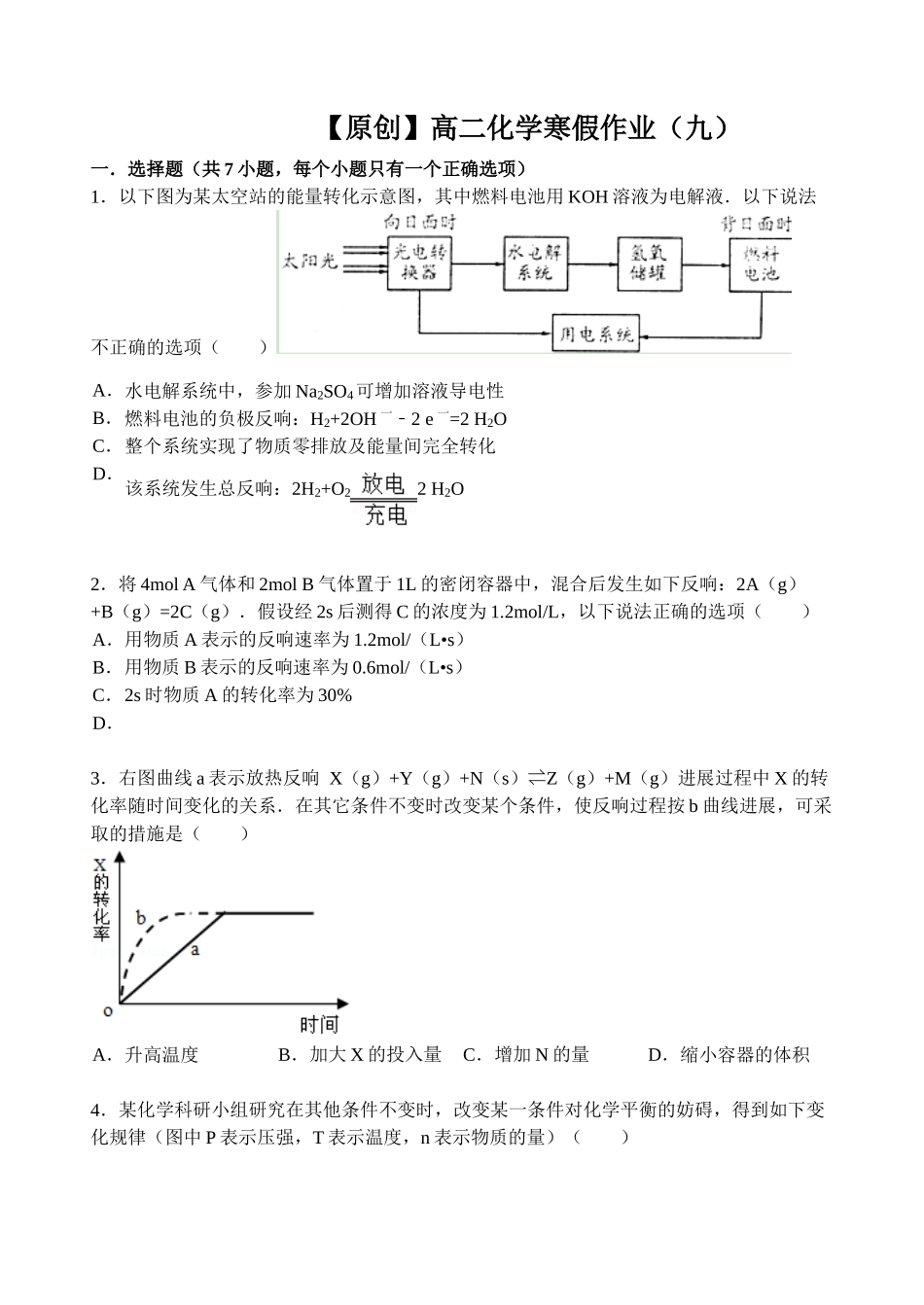
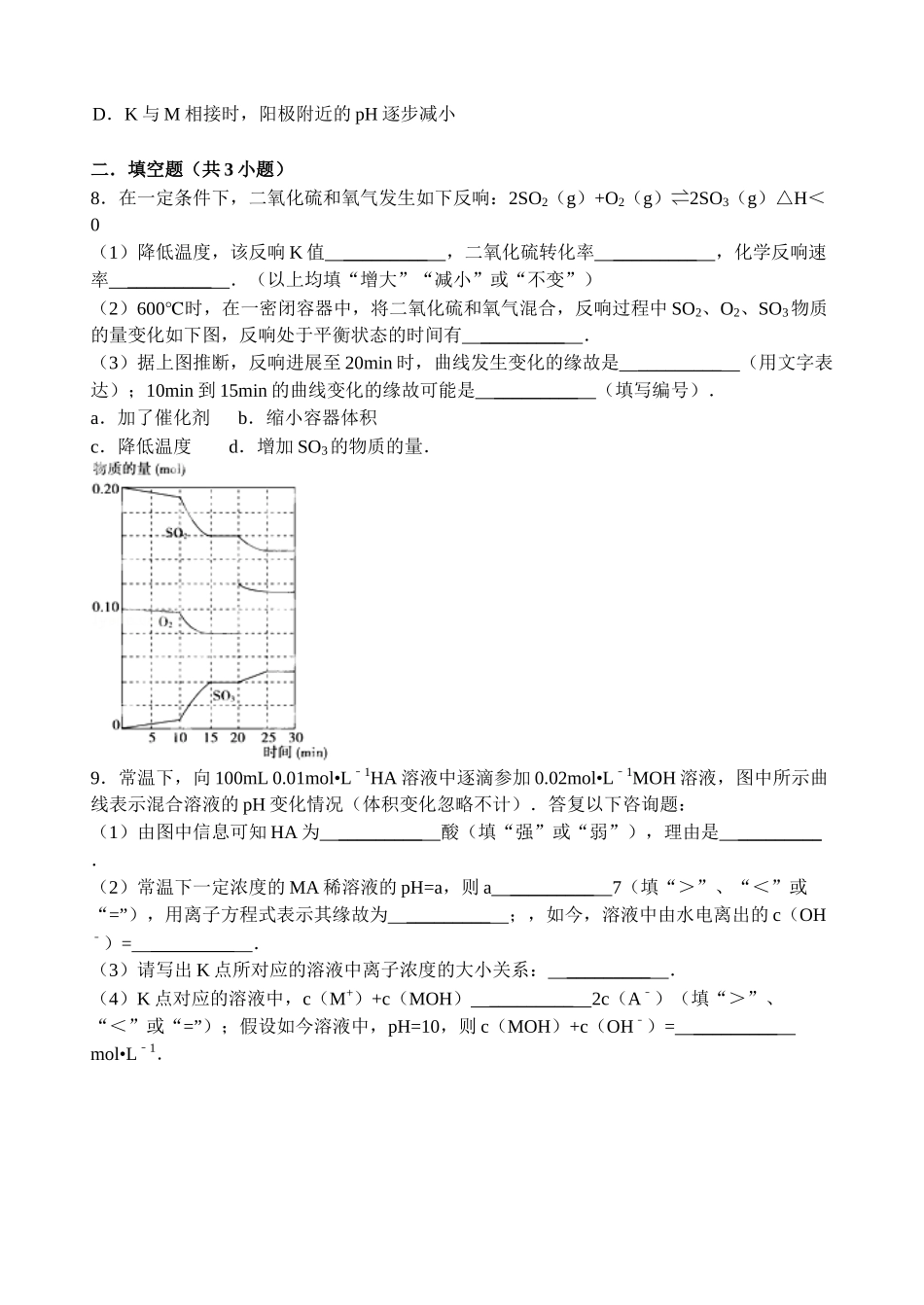
【原创】高二化学寒假作业(九)一.选择题(共7小题,每个小题只有一个正确选项)1.以下图为某太空站的能量转化示意图,其中燃料电池用KOH溶液为电解液.以下说法不正确的选项()A.水电解系统中,参加Na2SO4可增加溶液导电性B.燃料电池的负极反响:H2+2OH一﹣2e一=2H2OC.整个系统实现了物质零排放及能量间完全转化D.该系统发生总反响:2H2+O22H2O2.将4molA气体和2molB气体置于1L的密闭容器中,混合后发生如下反响:2A(g)+B(g)=2C(g).假设经2s后测得C的浓度为1.2mol/L,以下说法正确的选项()A.用物质A表示的反响速率为1.2mol/(L•s)B.用物质B表示的反响速率为0.6mol/(L•s)C.2s时物质A的转化率为30%D.3.右图曲线a表示放热反响X(g)+Y(g)+N(s)⇌Z(g)+M(g)进展过程中X的转化率随时间变化的关系.在其它条件不变时改变某个条件,使反响过程按b曲线进展,可采取的措施是()A.升高温度B.加大X的投入量C.增加N的量D.缩小容器的体积4.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的妨碍,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量)()A.反响Ⅰ:△H>0,P2>P1B.反响Ⅱ:△H>0,T1>T2C.反响Ⅲ:△H>0,T2>T1;或△H<0,T2>T1D.反响Ⅳ:△H<0,T2>T15.CO和H2在一定条件下能够合成乙醇:2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g),以下表达中能说明上述反响在一定条件下已到达最大限度的是()A.CO全部转化为乙醇B.正反响和逆反响的化学反响速率均为零C.CO和H2以1:2的物质的量之比反响生成乙醇D.反响体系中乙醇的物质的量浓度不再变化6.一定温度下对冰醋酸逐滴加水稀释,发生如图变化,图中Y轴的含义可能是()A.导电才能B.pHC.醋酸浓度D.溶液密度7.如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已经知道放电时电池反响为:Pb+PbO2+4H++2SO42﹣═2PbSO4+2H2O,以下有关说法正确的选项()A.K与N相接时,电解池密度增大B.K与N相接时,H+向负极区迁移C.K与M连接时,所用电源的b极为负极D.K与M相接时,阳极附近的pH逐步减小二.填空题(共3小题)8.在一定条件下,二氧化硫和氧气发生如下反响:2SO2(g)+O2(g)⇌2SO3(g)△H<0(1)降低温度,该反响K值_________,二氧化硫转化率_________,化学反响速率_________.(以上均填“增大”“减小”或“不变”)(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反响过程中SO2、O2、SO3物质的量变化如下图,反响处于平衡状态的时间有_________.(3)据上图推断,反响进展至20min时,曲线发生变化的缘故是_________(用文字表达);10min到15min的曲线变化的缘故可能是_________(填写编号).a.加了催化剂b.缩小容器体积c.降低温度d.增加SO3的物质的量.9.常温下,向100mL0.01mol•L1﹣HA溶液中逐滴参加0.02mol•L1﹣MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).答复以下咨询题:(1)由图中信息可知HA为_________酸(填“强”或“弱”),理由是_________.(2)常温下一定浓度的MA稀溶液的pH=a,则a_________7(填“>”、“<”或“=”),用离子方程式表示其缘故为_________;,如今,溶液中由水电离出的c(OH﹣)=_________.(3)请写出K点所对应的溶液中离子浓度的大小关系:_________.(4)K点对应的溶液中,c(M+)+c(MOH)_________2c(A﹣)(填“>”、“<”或“=”);假设如今溶液中,pH=10,则c(MOH)+c(OH﹣)=_________mol•L1﹣.10.T℃时反响2SO2(g)+O2(g)2SO3(g)过程中的能量变化如下图,答复以下咨询题.(1)写出该反响的热化学方程式(用E1、E2或E3表示,下同)_________(2)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反响.2min时反响到达平衡,如今测得反响物O2还剩余0.1mol,则到达平衡时SO2的转化率为_________,反响_________(填“放出”或“吸收”)_________热量.(用E1、E2或E3表示)(3)以下表达能证明该反响已达化学平衡状态的是_________(填序号)SO①2的体积分数不再发生变化②容器内压强不再发生变化...