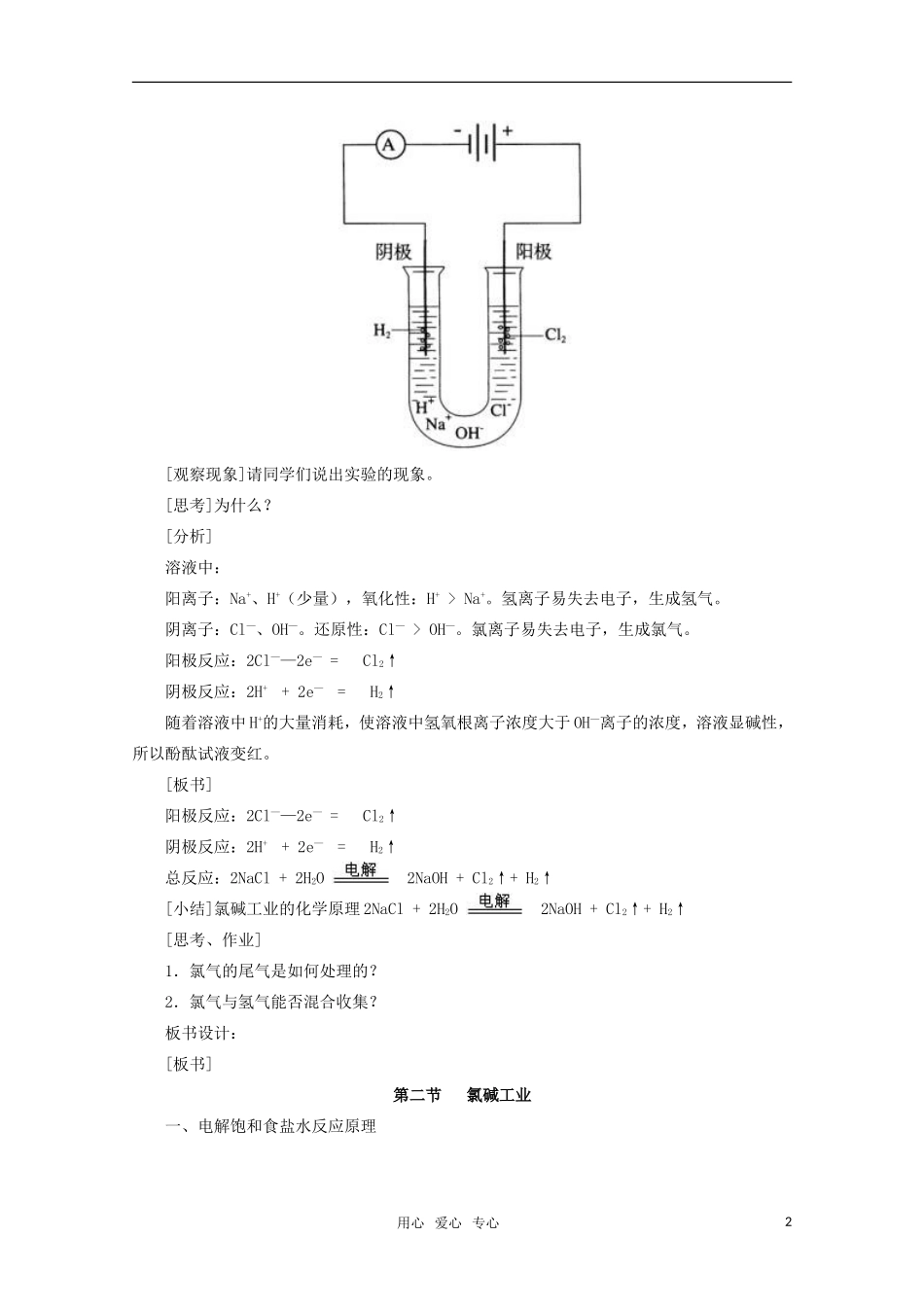
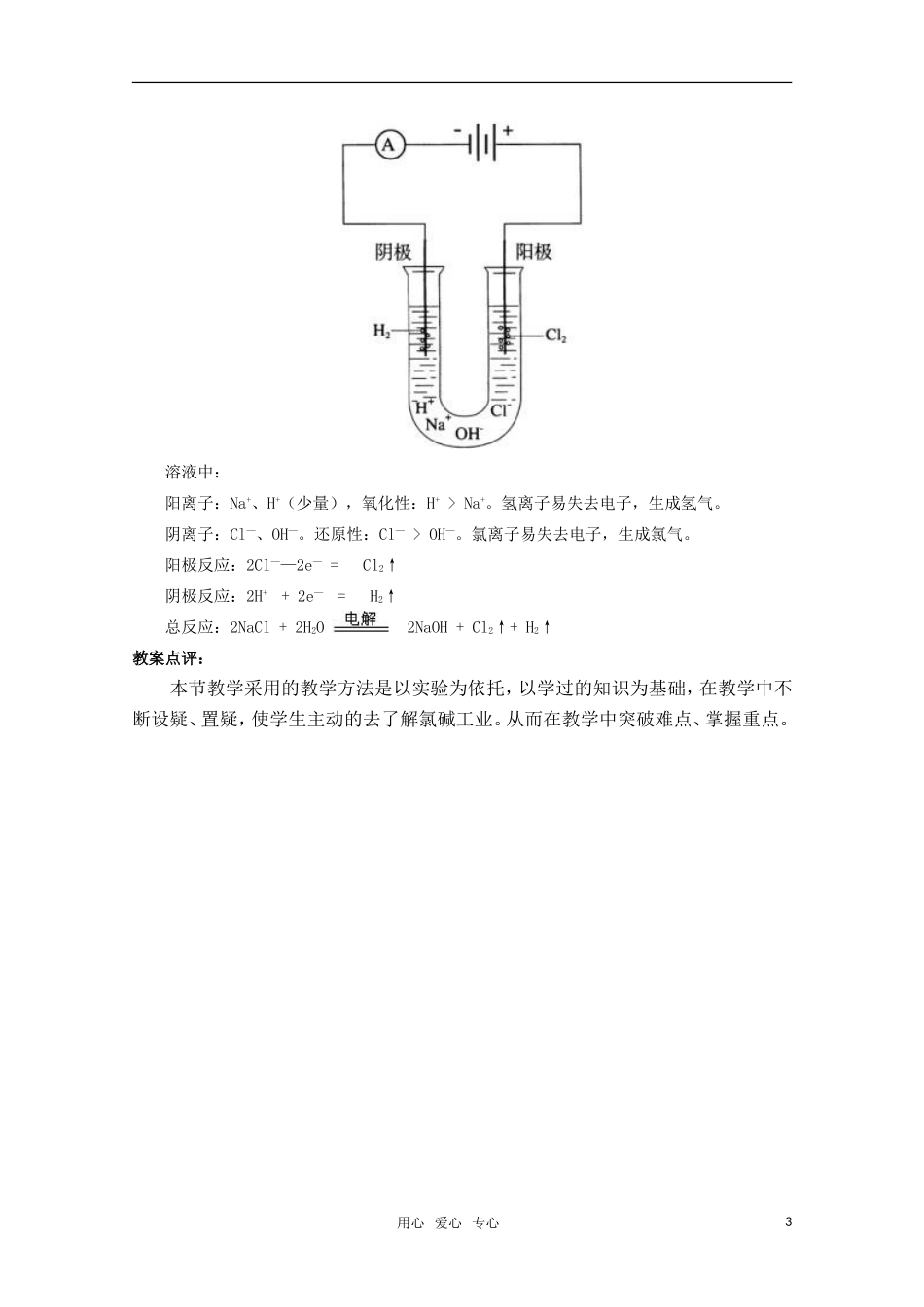
《氯碱工业》【教学目标】1.使学生了解氯碱工业反应原理。2.使学生了解电解槽。3.常识性介绍氯碱工业中食盐水的精制。4.使学生了解氯碱工业为基础的化工产品。【重点、难点】氯碱工业的反应原理。【课时安排】共二课时,此为第一课时。【教学准备】U形管、电源、电流计、碳棒;饱和食盐水、淀粉KI试纸、酚酞试液。【教学过程】[复习]在第一册卤族元素,我们了解氯气的工业制法,即用电解饱和氯化钠溶液可制取氯气,请同学回忆一下这个反应的方程式。[引入]工业上用电解饱和食盐水法来制取NaOH、H2、Cl2,并以它们为原料生一系列化工产品,称为氯碱工业。本节我们主要研究氯碱工业的化学原理。[板书]第二节氯碱工业一、电解饱和食盐水反应原理[讲解]在前面们学习了电解、电镀,在学习中我们知道电解时,阴极区聚集阳离子,阳极区聚集阴离子。依据氧化性、还原性强弱顺序电解出不同的产物。电解饱和食盐水,[思考]饱和氯化钠溶液中的成分?[分析]氯化钠电离:NaCl=Na++Cl-阳离子:Na+、H+(少量);阴离子:Cl-、OH—(少量)[演示实验4—3](建议在阳极区,即生成氯气的U形管一侧的管口,放置湿润的淀粉KI试纸来检验生成的氯气)用心爱心专心1[观察现象]请同学们说出实验的现象。[思考]为什么?[分析]溶液中:阳离子:Na+、H+(少量),氧化性:H+>Na+。氢离子易失去电子,生成氢气。阴离子:Cl—、OH—。还原性:Cl—>OH—。氯离子易失去电子,生成氯气。阳极反应:2Cl——2e—=Cl2↑阴极反应:2H++2e—=H2↑随着溶液中H+的大量消耗,使溶液中氢氧根离子浓度大于OH—离子的浓度,溶液显碱性,所以酚酞试液变红。[板书]阳极反应:2Cl——2e—=Cl2↑阴极反应:2H++2e—=H2↑总反应:2NaCl+2H2O2NaOH+Cl2↑+H2↑[小结]氯碱工业的化学原理2NaCl+2H2O2NaOH+Cl2↑+H2↑[思考、作业]1.氯气的尾气是如何处理的?2.氯气与氢气能否混合收集?板书设计:[板书]第二节氯碱工业一、电解饱和食盐水反应原理用心爱心专心2溶液中:阳离子:Na+、H+(少量),氧化性:H+>Na+。氢离子易失去电子,生成氢气。阴离子:Cl—、OH—。还原性:Cl—>OH—。氯离子易失去电子,生成氯气。阳极反应:2Cl——2e—=Cl2↑阴极反应:2H++2e—=H2↑总反应:2NaCl+2H2O2NaOH+Cl2↑+H2↑教案点评:本节教学采用的教学方法是以实验为依托,以学过的知识为基础,在教学中不断设疑、置疑,使学生主动的去了解氯碱工业。从而在教学中突破难点、掌握重点。用心爱心专心3