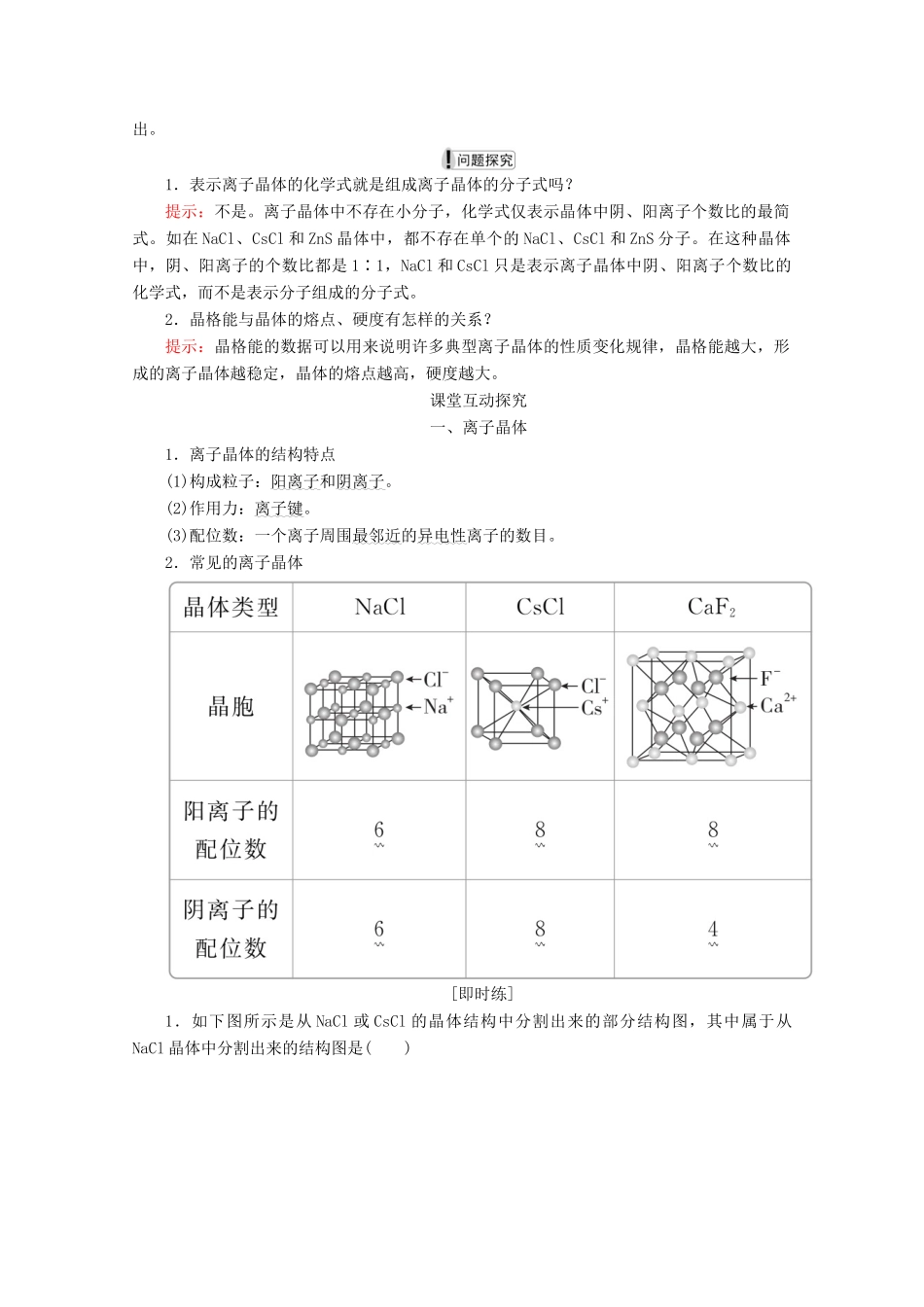
第四节离子晶体[明确学习目标]1.能说明离子键的形成,能根据离子化合物的结构特征解释其物理性质。2.了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。学生自主学习一、离子晶体1.定义:由□阳离子和□阴离子通过□离子键结合而成的晶体。2.晶体结构的决定因素3.离子晶体的性质4.三种常见离子晶体的结构(1)NaCl型①如右图所示,每个Na+周围距离最近的Cl-是□6个(上、下、左、右、前、后各□1个,即配位数是□6),构成正八面体;每个Cl-周围距离最近的Na+也是□6个(即配位数是□6),构成正八面体。由此可推知该晶体的化学式为□NaCl。②每个Na+周围距离最近的Na+是□12个(上层□4个,同层□4个,下层□4个),每个Cl-周围距离最近的Cl-也是□12个。③每个晶胞中实际拥有的Na+数是□4,Cl-数是□4。由此也可推知该晶体的化学式为□NaCl。(2)CsCl型①如下图,每个Cs+周围距离最近的Cl-是□8个(即配位数是□8),构成正六面体;每个Cl-周围距离最近的Cs+也是□8个(即配位数是□8),构成□正六面体。由此可推知该晶体的化学式为□CsCl。②每个Cs+周围距离最近的Cs+是□6个(上、下、左、右、前、后各□1个),构成□正八面体;每个Cl-周围距离最近的Cl-也是□6个,构成□正八面体。③每个晶胞中实际拥有的Cs+数是□1____,Cl-数是□1。由此也可推知该晶体的化学式为□CsCl。(3)CaF2晶体(如图所示)每个Ca2+周围最邻近的F-有□8个,即Ca2+的配位数为□8;每个F-周围最邻近的Ca2+有□4个,即F-的配位数为□4。在CaF2晶体中,Ca2+和F-个数比是□1∶2,刚好与Ca2+和F-的电荷数之比相反。Ca2+在大立方体的□顶角和□面心,□8个F-在大立方体内构成一个小立方体。二、晶格能1.晶格能的概念是□气态离子形成1摩尔离子晶体释放的能量,通常取正值。单位:□kJ·mol-1。2.晶格能的意义(1)晶格能是最能反映离子晶体□稳定性的数据,晶格能越大,离子键越□牢固,晶体越□稳定,而且熔点□越高,硬度□越大。BaOSrOCaO核间距/10-12m277257240晶格能/kJ·mol-1305432233401熔点/K191824302614摩氏硬度3.33.54.5(2)晶格能与岩浆晶出规则:岩浆晶出的次序与晶格能的大小有关。一般地,晶格能□大的矿物先晶出,晶格能□小的矿物后晶出,即晶格能越□大,岩浆中的矿物越□易结晶析出。1.表示离子晶体的化学式就是组成离子晶体的分子式吗?提示:不是。离子晶体中不存在小分子,化学式仅表示晶体中阴、阳离子个数比的最简式。如在NaCl、CsCl和ZnS晶体中,都不存在单个的NaCl、CsCl和ZnS分子。在这种晶体中,阴、阳离子的个数比都是1∶1,NaCl和CsCl只是表示离子晶体中阴、阳离子个数比的化学式,而不是表示分子组成的分子式。2.晶格能与晶体的熔点、硬度有怎样的关系?提示:晶格能的数据可以用来说明许多典型离子晶体的性质变化规律,晶格能越大,形成的离子晶体越稳定,晶体的熔点越高,硬度越大。课堂互动探究一、离子晶体1.离子晶体的结构特点(1)构成粒子:阳离子和阴离子。(2)作用力:离子键。(3)配位数:一个离子周围最邻近的异电性离子的数目。2.常见的离子晶体[即时练]1.如下图所示是从NaCl或CsCl的晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是()A.图(1)和(3)B.图(2)和(3)C.图(1)和(4)D.只有图(4)答案C解析NaCl晶体中,每个Na+周围最邻近的Cl-有6个,构成正八面体,同理,每个Cl-周围最邻近的6个Na+也构成正八面体,由此可知图(1)和(4)是从NaCl晶体中分割出来的结构图。2.同类晶体物质熔点的变化是有规律的,试分析下列两组物质熔点规律性变化的原因:A组物质NaClKClCsCl熔点/K10741049918B组物质NaMgAl熔点/K370922933晶体熔点的高低,取决于组成晶体微粒间的作用力的大小。A组物质是________晶体,晶体中微粒之间通过________相连。B组物质是________晶体,价电子数由少到多的顺序是________,粒子半径由大到小的顺序是________________。答案离子离子键金属Na<Mg<AlNa>Mg>Al解析A组物质为离子晶体,离子之间通过离子键相结合,由于NaCl、KCl、CsCl中的阴、阳离子所带电荷数相等,而r(...