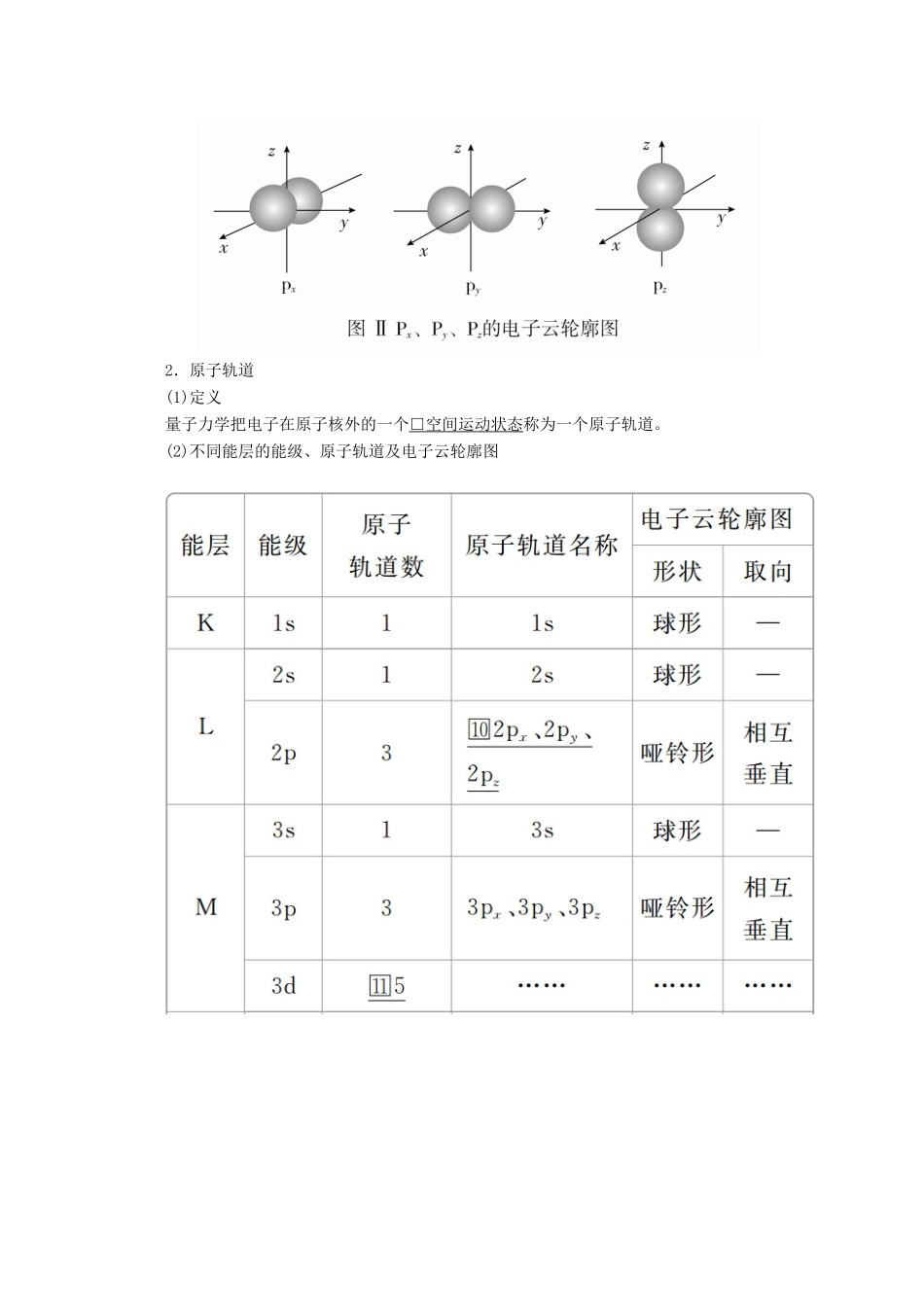
原子核外电子排布所遵循的原理原子轨道[明确学习目标]1.了解能量最低原理,知道基态与激发态及原子核外电子在一定条件下会发生跃迁产生原子光谱。2.了解原子核外电子的运动状态;知道电子云和原子轨道;掌握泡利原理和洪特规则;掌握1~36号元素的原子核外电子排布式和电子排布图。学生自主学习一、能量最低原理、基态与激发态1.能量最低原理原子的电子排布遵循□构造原理能使整个原子的能量处于□最低状态。2.基态与激发态基态原子:处于□最低能量的原子叫做基态原子。激发态原子:基态原子的电子□吸收能量后,电子会跃迁到□较高能级,变为激发态原子。电子从□较高能量的激发态跃迁到□较低能量的激发态乃至基态时,将□释放能量。基态原子((((激发态原子。3.原子光谱不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的□吸收光谱或□发射光谱,总称原子光谱。二、电子云和原子轨道1.电子云(1)电子云是处于□一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。(2)电子云轮廓图①将电子在原子核外空间出现的概率□P=90%的空间圈出来,制作电子云的轮廓图,便可描绘电子云的形状。②s电子、p电子的电子云轮廓图所有原子的任一能层的s电子的电子云轮廓图都是□球形的,同一原子的能层□越高,s电子云的半径□越大,如下图Ⅰ所示。这是由于1s、2s、3s……电子的能量依次增高,电子在离核更远的区域出现的概率逐渐□增大,电子云越来越向更大的空间扩展。除s电子云外,其他空间运动状态的电子云都不是球形的,如p电子云是□哑铃状的。每个p能级都有3个□相互垂直的电子云,分别称为px、py和pz,如图Ⅱ所示。p电子云的平均半径随能层序数的增大而增大。2.原子轨道(1)定义量子力学把电子在原子核外的一个□空间运动状态称为一个原子轨道。(2)不同能层的能级、原子轨道及电子云轮廓图注:d轨道和f轨道各有名称、形状和取向,此处不作讲解。三、泡利原理和洪特规则1.泡利原理在任何一个原子里,不可能有运动状态完全相同的两个电子。一个原子轨道里最多只能容纳□2个电子,而且自旋方向□相反。2.洪特规则当电子排布在同一能级的不同轨道时(即能量相同的轨道),总是优先□单独占据一个轨道,而且自旋方向□相同。3.电子排布图用□方框表示原子轨道,用不同方向的箭头表示自旋状态不同的电子的式子。如:C:;N:。1.焰色反应是利用每种元素都有其特征光谱,鉴定物质中所含元素的方法,该方法是化学变化吗?提示:焰色反应是电子跃迁的结果,故焰色反应是物理变化而不是化学变化。2.电子云图上的小黑点代表电子本身吗?提示:电子云图上的小黑点是指电子在原子核外出现的概率密度的形象描述,不是电子本身,小黑点越密,表明概率密度越大。3.在写基态原子的电子排布图时:请说出以上3个电子排布图各违背了哪些原理,并写出正确的电子排布图。提示:(1)违背了能量最低原理,其正确的电子排布图为。(2)违背了泡利原理,其正确的电子排布图为。(3)违背了洪特规则,其正确的电子排布图为。课堂互动探究一、光谱与光谱分析1.基态、激发态与光谱2.光谱分析:在现代化学中,利用原子光谱上的特征谱线来鉴定元素的分析方法。[即时练]1.基态原子和激发态原子相比较()A.基态原子的能量比激发态原子高B.基态原子放出能量变成激发态原子C.基态原子比激发态原子稳定D.激发态原子比基态原子稳定答案C解析基态原子吸收能量后变为激发态原子,故激发态原子不如基态原子稳定。2.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是()A.电子由激发态向基态跃迁时以光的形式释放能量B.电子由基态向激发态跃迁时吸收除红光以外的光线C.氖原子获得电子后转变成发出红光的物质D.在电流的作用下,氖原子与构成灯管的物质发生了化学反应答案A解析在电流作用下,基态氖原子中的电子吸收能量跃迁到较高能级,变为激发态原子,这一过程要吸收能量,不会发出红色光;而电子从较高能量的激发态向基态跃迁时,将释放能量,从而产生红色光,故A项正确。规律方法一般情况下,原子核外电子排布遵循构造原理时,原子的能量处于最...