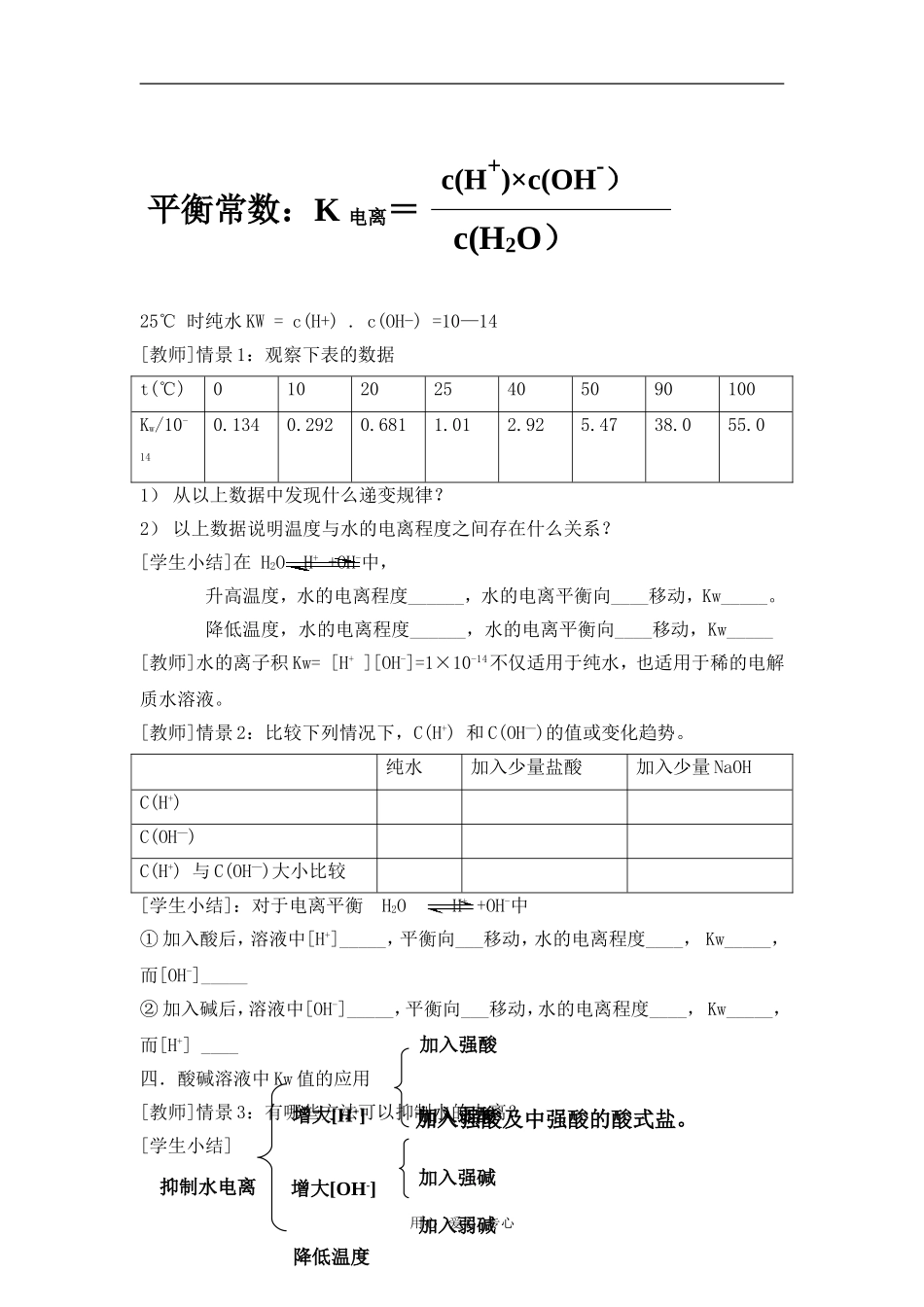
第二节水的电离和溶液的酸碱性教学目标:1、理解水的电离及水的离子积常数2、理解溶液酸碱性与pH值的测量3、加深学生理解弱电解质的电离平衡以及浓度等条件对电离平衡的影响。第一课时一.知识回顾1、什么是pH?酸性的pH_______;中性的pH_________;碱性的pH_________。2、水的pH_________,水中有没有H+、OH-?二.水的电离与水的离子积常数[教师]水中存在哪些离子?[学生]水是一种极弱的电解质,电离方程式可表示为:H2O+H2OH3O++OH-或H2OH++OH-[定性讨论]纯水的组成微粒有哪些?作为弱电解质,水的电离平衡受哪些外界因素影响?温度、离子浓度(H+、OH-)等影响[定量讨论]阅读教材P45---P46思考1:纯水中c(H+)与c(OH-)大小有何关系?由水电离出的H+、OH-的物质的量相等思考2:在25℃下,c(H+)、c(OH-)等于多少?说明水的电离程度如何?25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L水是一种极弱的电解质(通常的电流表无法检验其中离子)三、Kw1.水是一种极弱的电解质,能微弱的电离:例、水是一种极弱的电解质,在室温下,平均每n个分子只有1个分子发生电离,则n值是:A、10-14B、55.6×107C、107D、55.6用心爱心专心++25℃时纯水KW=c(H+).c(OH-)=10—14[教师]情景1:观察下表的数据t(℃)0102025405090100Kw/10-140.1340.2920.6811.012.925.4738.055.01)从以上数据中发现什么递变规律?2)以上数据说明温度与水的电离程度之间存在什么关系?[学生小结]在H2OH++OH-中,升高温度,水的电离程度______,水的电离平衡向____移动,Kw_____。降低温度,水的电离程度______,水的电离平衡向____移动,Kw_____[教师]水的离子积Kw=[H+][OH-]=1×10-14不仅适用于纯水,也适用于稀的电解质水溶液。[教师]情景2:比较下列情况下,C(H+)和C(OH—)的值或变化趋势。纯水加入少量盐酸加入少量NaOHC(H+)C(OH—)C(H+)与C(OH—)大小比较[学生小结]:对于电离平衡H2OH++OH-中①加入酸后,溶液中[H+]_____,平衡向___移动,水的电离程度____,Kw_____,而[OH-]_____②加入碱后,溶液中[OH-]_____,平衡向___移动,水的电离程度____,Kw_____,而[H+]____四.酸碱溶液中Kw值的应用[教师]情景3:有哪些方法可以抑制水的电离?[学生小结]用心爱心专心平衡常数:K电离=c(H2O)加入强酸及中强酸的酸式盐。加入强酸增大[OH-]增大[H+]降低温度抑制水电离加入弱酸加入强碱加入弱碱c(H+)×c(OH-)[教师]情景4:请分析1mol/L盐酸溶液中存在哪些离子,且各离子的浓度是多少?请分析1mol/LNaOH溶液中存在哪些离子,且各离子的浓度是多少?[引申]判断溶液酸碱性强弱的依据是什么?[学生小结]溶液的酸碱性酸性溶液:C(H+)______C(OH—),C(H+)______1.0×10-7mol/L碱性溶液:C(H+)______C(OH—),C(H+)______1.0×10-7mol/L中性溶液:C(H+)______C(OH—),C(H+)______1.0×10-7mol/L第二课时复习练习一、判断:1、任何水溶液中都存在KW=10-14。2、某水溶液中c(H+)=10-6一定是酸性溶液。3、向纯水中加入溶质,水的电离平衡将向逆向移动4、如果由水电离出的H+浓度为10-10,则Kw=10-20二、计算:1、常温下,10-4mol/L的盐酸溶液.溶液中,c(OH-)=________mol/L.将上述盐酸稀释10倍,溶液中c(H+)=_______mol/L、c(OH-)=_____mol/L。将上述溶液稀释10000倍,溶液中c(H+)=_________、c(OH-)=___________。2、常温下,某溶液中由水电离出的H+和OH-浓度的乘积为1×10-24mol/L,该溶液的[H+]可能为_______二.溶液的酸碱性用心爱心专心[教师]溶液呈酸性、碱性还是中性,其依据是什么?A.应看c(H+)和c(OH-)的相对大小B.应看c(H+)与1×10-7mol/L相对大小比较C.应看pH值[学生]溶液酸碱性的判断关键看c(H+)和c(OH-)的相对大小[引申]B与C选项作出什么的补充才可用于判断溶液的酸碱性?[学生]1×10-7mol/L与pH=7的临界标准适合于常温下在溶液。三.pH值的计算[教师]pH是氢离子浓度的负对数(室温),pH=—lgc(H+)[练习1]取1mol/L的HCl溶液,其pH是多少?取1mol/L的硫酸,其pH是多少?[练习2]1mLpH=3的HCl溶液,其c(H+)是多少?[练习3]1mLpH=3的HCl溶液加水稀释到100mL后,溶液的pH是多少?[练习4]取pH=12的NaOH溶液与水按1:9...