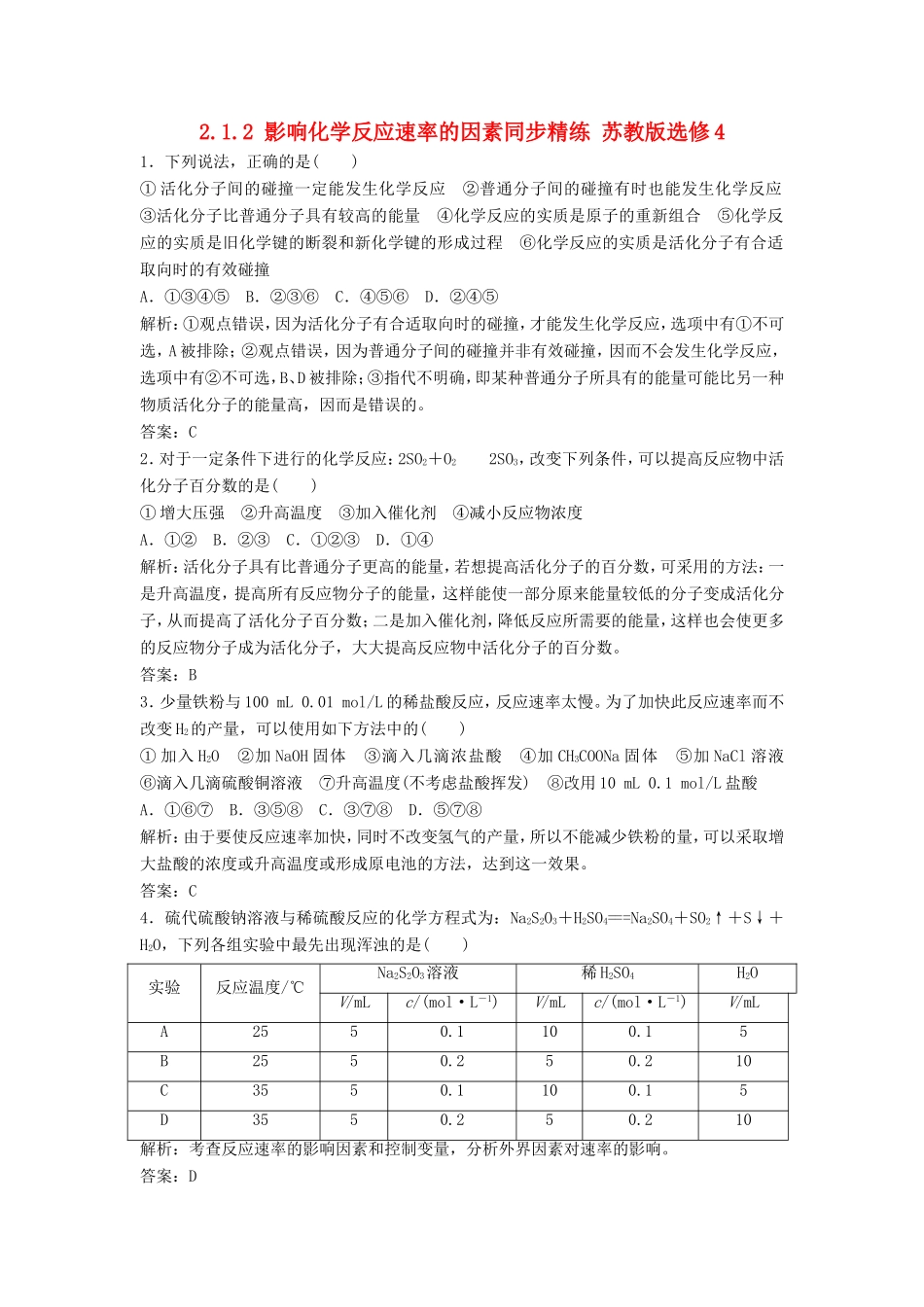
2.1.2影响化学反应速率的因素同步精练苏教版选修41.下列说法,正确的是()①活化分子间的碰撞一定能发生化学反应②普通分子间的碰撞有时也能发生化学反应③活化分子比普通分子具有较高的能量④化学反应的实质是原子的重新组合⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程⑥化学反应的实质是活化分子有合适取向时的有效碰撞A.①③④⑤B.②③⑥C.④⑤⑥D.②④⑤解析:①观点错误,因为活化分子有合适取向时的碰撞,才能发生化学反应,选项中有①不可选,A被排除;②观点错误,因为普通分子间的碰撞并非有效碰撞,因而不会发生化学反应,选项中有②不可选,B、D被排除;③指代不明确,即某种普通分子所具有的能量可能比另一种物质活化分子的能量高,因而是错误的。答案:C2.对于一定条件下进行的化学反应:2SO2+O22SO3,改变下列条件,可以提高反应物中活化分子百分数的是()①增大压强②升高温度③加入催化剂④减小反应物浓度A.①②B.②③C.①②③D.①④解析:活化分子具有比普通分子更高的能量,若想提高活化分子的百分数,可采用的方法:一是升高温度,提高所有反应物分子的能量,这样能使一部分原来能量较低的分子变成活化分子,从而提高了活化分子百分数;二是加入催化剂,降低反应所需要的能量,这样也会使更多的反应物分子成为活化分子,大大提高反应物中活化分子的百分数。答案:B3.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的()①加入H2O②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸A.①⑥⑦B.③⑤⑧C.③⑦⑧D.⑤⑦⑧解析:由于要使反应速率加快,同时不改变氢气的产量,所以不能减少铁粉的量,可以采取增大盐酸的浓度或升高温度或形成原电池的方法,达到这一效果。答案:C4.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是()实验反应温度/℃Na2S2O3溶液稀H2SO4H2OV/mLc/(mol·L-1)V/mLc/(mol·L-1)V/mLA2550.1100.15B2550.250.210C3550.1100.15D3550.250.210解析:考查反应速率的影响因素和控制变量,分析外界因素对速率的影响。答案:D5.试分析下列可逆反应2A(g)+B(g)2C(g)的反应速率随压强变化的曲线图正确的是()解析:增大压强,正、逆反应速率均加快,此反应是一个气体的物质的量减少的反应,因此,正反应速率加快的倍数比逆反应速率加快的倍数大。故选C。答案:C6.在一定温度下,A、B能在溶液中发生反应生成C和D:A+B===C+D。a.将0.2mol/LA溶液和0.2mol/LB溶液各20mL混合b.将0.5mol/LA溶液和0.5mol/LB溶液各50mL混合c.将1mol/LA溶液和1mol/LB溶液各10mL混合,同时倒入30mL蒸馏水d.将1mol/LA溶液20mL和1.2mol/LB溶液60mL混合反应开始时,反应速率由大到小的顺序是________。解析:本题需先把每种情况下混合溶液中A、B的起始浓度求出来,然后根据其浓度大小来比较化学反应速率的大小。混合后各物质的起始浓度(mol/L)为:abcdA0.100.250.200.25B0.100.250.200.9混合后浓度最大的是d,其次是b,最小的是a,所以反应开始时,反应速率由大到小的顺序为d>b>c>a。答案:d>b>c>a7.100mL6mol·L-1的H2SO4溶液与足量的锌粉反应,在一定温度下加入下列物质,试将对v(H2)和n(H2)的影响填入下表:加入物质对v(H2)影响对n(H2)影响Na2CO3固体K2SO4溶液NaNO3固体通入一定量HCl气体解析:H2SO4和Zn反应的离子方程式为2H++Zn===Zn2++H2↑,H+的浓度的变化影响着反应速率,产生H2的物质的量受参与反应的H+的物质的量影响。加入Na2CO3固体时,消耗部分H2SO4,减小H+的物质的量和浓度;加入K2SO4溶液时,相当于加水稀释,H+的物质的量不变,但浓度减少;加入NaNO3固体时,引入NO,NO在H+的存在下与Zn反应,不生成H2;通入HCl时,HCl===H++Cl-,增大H+的物质的量和浓度。答案:加入物质对v(H2)影响对n(H2)影响Na2CO3固体减小减小K2SO4溶液减小不变NaNO3固体减小减小通入一定量HCl气体增大...