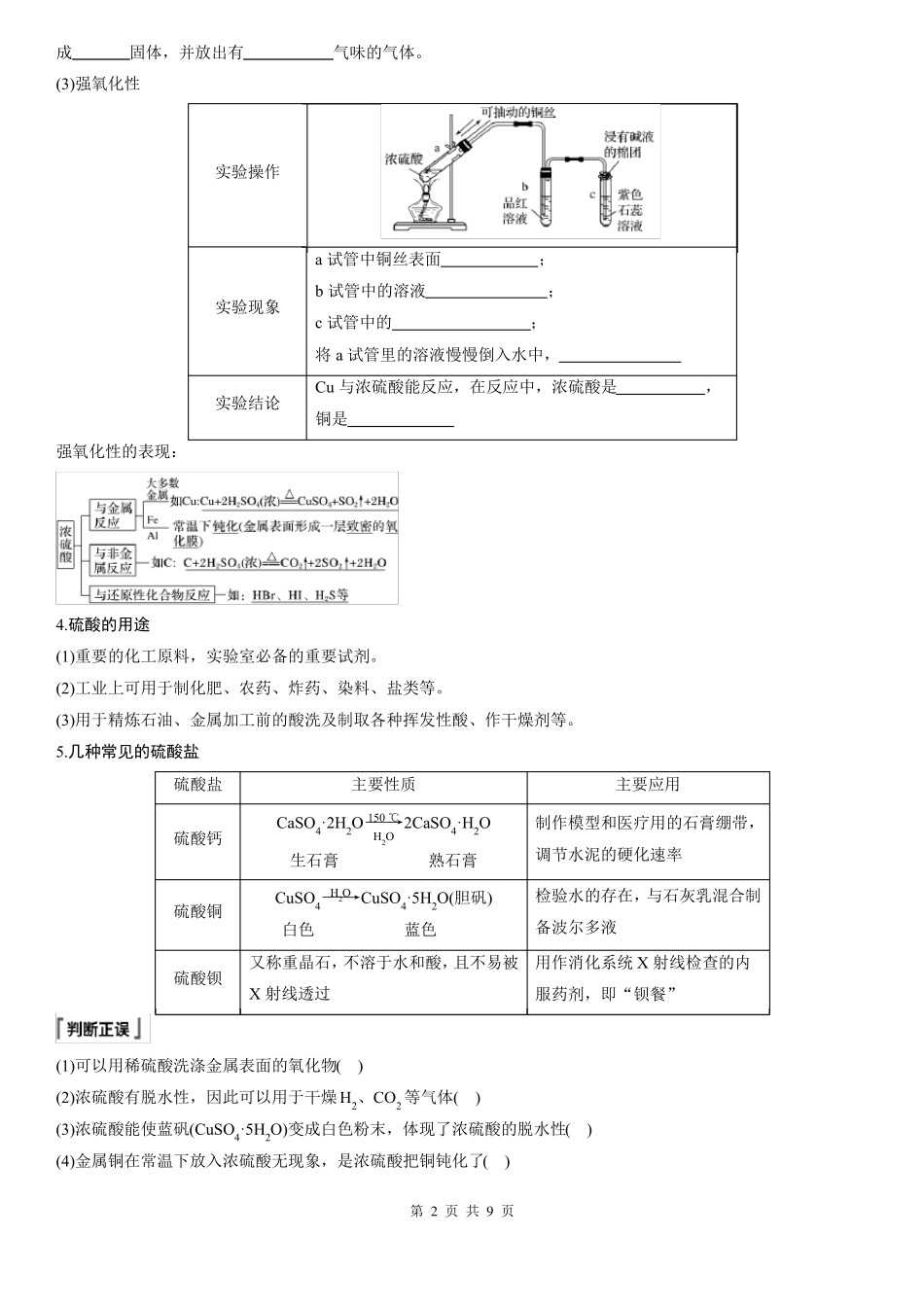
第2课时硫酸和硫酸根离子的检验一、硫酸1.硫酸的工业制法接触法制硫酸分为三个阶段,填写下表:三阶段三原料三反应(均放热)1.造气(生成SO2)2.接触氧化(生成SO3)3.SO3吸收(生成H2SO4)注意工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应放热,易产生酸雾,影响SO3的吸收。2.硫酸的性质(1)物理性质纯净的硫酸是黏稠状液体,密度比水,能与水以任意比混合,沸点,难挥发。(2)酸的通性H2SO4在水里很容易电离出,具有,能使紫色石蕊溶液显,请写出下列反应的离子方程式。①和活泼金属(如Fe):;②和金属氧化物(如MgO):;③和碱[如Mg(OH)2]:;④和盐(如Na2CO3):。3.浓硫酸的特性实验室常用的浓硫酸质量分数为98.3%,密度为1.84g·cm3,比水,且浓度越大密度越大。沸点,挥发,常温下比较稳定。浓硫酸的三大特性:、和。(1)吸水性浓硫酸能够吸收气体、液体中的水分子及固体中的结晶水,故常用作。(2)脱水性-浓硫酸能把有机物中的氢和氧按脱去。如向蔗糖中加入浓硫酸时,蔗糖逐渐变黑,体积膨胀,形第1页共9页成固体,并放出有气味的气体。(3)强氧化性实验操作a试管中铜丝表面;实验现象b试管中的溶液;c试管中的;将a试管里的溶液慢慢倒入水中,实验结论强氧化性的表现:Cu与浓硫酸能反应,在反应中,浓硫酸是,铜是4.硫酸的用途(1)重要的化工原料,实验室必备的重要试剂。(2)工业上可用于制化肥、农药、炸药、染料、盐类等。(3)用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。5.几种常见的硫酸盐硫酸盐硫酸钙主要性质CaSO4·2H2O――→2CaSO4·H2OHO2主要应用制作模型和医疗用的石膏绷带,调节水泥的硬化速率检验水的存在,与石灰乳混合制备波尔多液用作消化系统X射线检查的内服药剂,即“钡餐”150℃生石膏熟石膏硫酸铜CuSO4――→CuSO4·5H2O(胆矾)白色蓝色硫酸钡又称重晶石,不溶于水和酸,且不易被X射线透过H2O(1)可以用稀硫酸洗涤金属表面的氧化物()(2)浓硫酸有脱水性,因此可以用于干燥H2、CO2等气体()(3)浓硫酸能使蓝矾(CuSO4·5H2O)变成白色粉末,体现了浓硫酸的脱水性()(4)金属铜在常温下放入浓硫酸无现象,是浓硫酸把铜钝化了()第2页共9页(5)100mL18.0mol·L-1的浓硫酸和足量铜反应生成SO2的分子数目为0.9NA()(6)浓硫酸有强烈的吸水性,因此可以干燥SO2、H2S、HI、NH3等气体()(7)蔗糖和浓硫酸的“黑面包”实验中,主要体现了浓硫酸的脱水性和强氧化性()1.下列各过程主要表现了浓硫酸的哪些性质?请将答案的序号分别填在横线上。①强酸性②强氧化性③高沸点、难挥发性④脱水性⑤吸水性(1)用氯化钠固体和浓硫酸在加热条件下制氯化氢气体________。(2)用磷矿物(主要成分是磷酸钙)和硫酸反应制磷酸________。(3)浓硫酸干燥氢气、氧气、氯气、二氧化硫等气体__________。(4)常温下可以用铁或铝的容器贮存浓硫酸________。(5)胆矾放在盛浓硫酸的干燥器中变成白色粉末____________。(6)不能用浓硫酸干燥溴化氢、碘化氢和硫化氢等气体________。(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑________________。2.(1)50mL物质的量浓度为18mol·L-1的硫酸中加入足量铜片并加热,充分反应,被还原的硫酸____0.9mol(填“大于”“等于”或“小于”,下同),消耗铜的物质的量_____0.45mol。原因是_______________________________。(2)将一定量的锌与100mL18.5mol·L1浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H)=0.1mol·L1,则下列叙述正确的是_____(填字母)。A.气体A为SO2和H2的混合物B.气体A中SO2和H2的体积比为4∶1C.反应中共消耗Zn97.5gD.反应中共转移3mol电子(1)浓硫酸作干燥剂的注意点①可干燥酸性气体(如CO2、SO2、Cl2等)和中性气体(如O2、N2、CO等)。②不可干燥的气体:碱性气体(如NH3)和某些还原性气体(如HBr、HI、H2S等)。(2)浓硫酸和金属反应的规律①浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。②浓硫酸与不活泼金属(如铜)反应时,随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,就不再与不活泼金属反应。③浓硫酸与活泼金属(如锌)反应...