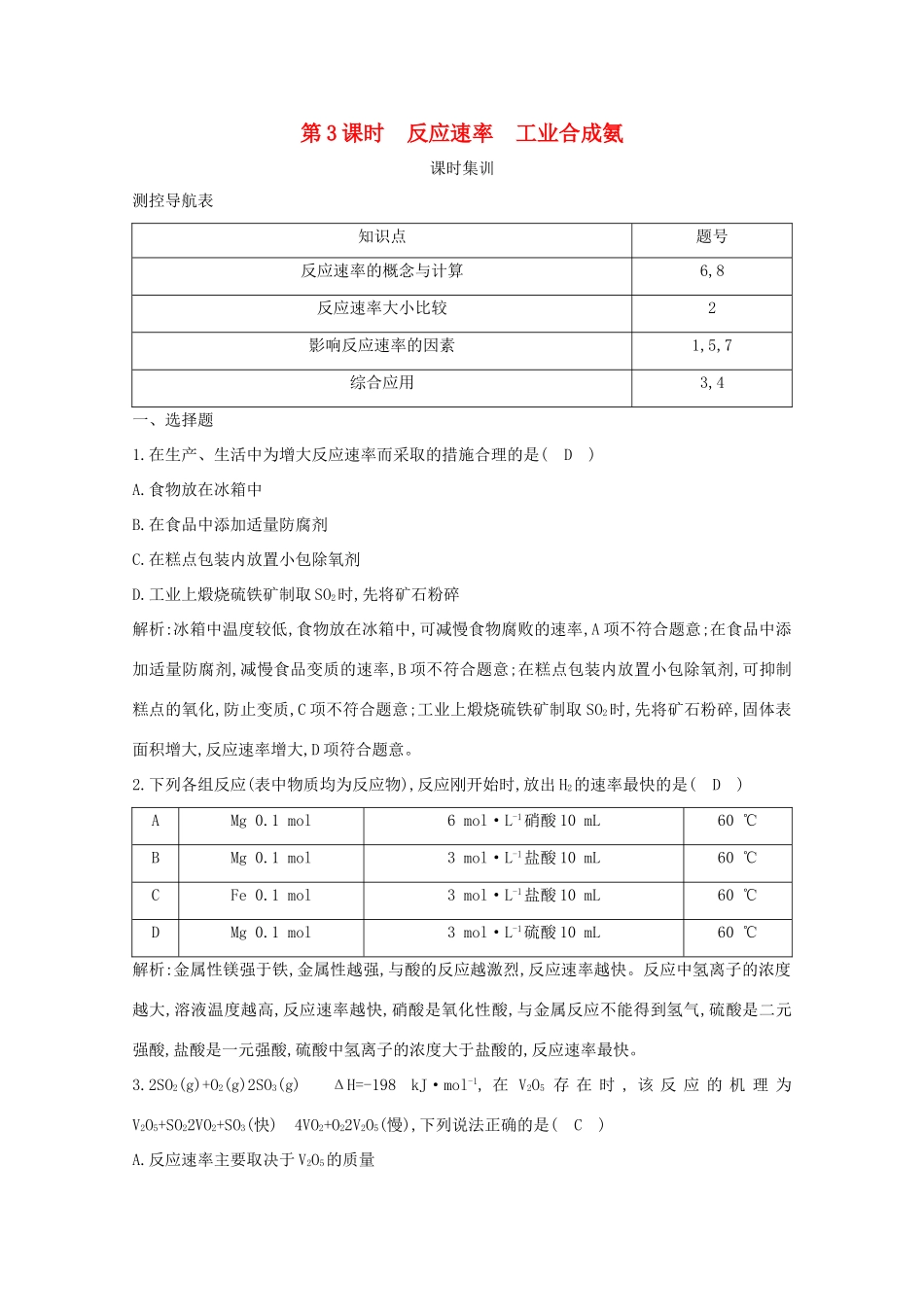
第3课时反应速率工业合成氨课时集训测控导航表知识点题号反应速率的概念与计算6,8反应速率大小比较2影响反应速率的因素1,5,7综合应用3,4一、选择题1.在生产、生活中为增大反应速率而采取的措施合理的是(D)A.食物放在冰箱中B.在食品中添加适量防腐剂C.在糕点包装内放置小包除氧剂D.工业上煅烧硫铁矿制取SO2时,先将矿石粉碎解析:冰箱中温度较低,食物放在冰箱中,可减慢食物腐败的速率,A项不符合题意;在食品中添加适量防腐剂,减慢食品变质的速率,B项不符合题意;在糕点包装内放置小包除氧剂,可抑制糕点的氧化,防止变质,C项不符合题意;工业上煅烧硫铁矿制取SO2时,先将矿石粉碎,固体表面积增大,反应速率增大,D项符合题意。2.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最快的是(D)AMg0.1mol6mol·L-1硝酸10mL60℃BMg0.1mol3mol·L-1盐酸10mL60℃CFe0.1mol3mol·L-1盐酸10mL60℃DMg0.1mol3mol·L-1硫酸10mL60℃解析:金属性镁强于铁,金属性越强,与酸的反应越激烈,反应速率越快。反应中氢离子的浓度越大,溶液温度越高,反应速率越快,硝酸是氧化性酸,与金属反应不能得到氢气,硫酸是二元强酸,盐酸是一元强酸,硫酸中氢离子的浓度大于盐酸的,反应速率最快。3.2SO2(g)+O2(g)2SO3(g)ΔH=-198kJ·mol-1,在V2O5存在时,该反应的机理为V2O5+SO22VO2+SO3(快)4VO2+O22V2O5(慢),下列说法正确的是(C)A.反应速率主要取决于V2O5的质量B.VO2是该反应的催化剂C.逆反应的活化能大于198kJ·mol-1D.增大SO2的浓度可显著提高反应速率解析:由反应机理可得,V2O5是该反应的催化剂,反应速率与催化剂V2O5的质量有一定关系,但主要取决于催化剂V2O5的表面积,故A、B项都错误;ΔH=正反应的活化能-逆反应的活化能=-198kJ·mol-1,所以逆反应的活化能大于198kJ·mol-1,故C项正确;使用催化剂可以显著提高反应速率,增大SO2的浓度可以提高反应速率,但不是显著提高,故D项错误。4.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是(B)A.①②③B.②④⑤C.①③⑤D.②③④解析:合成氨反应为N2(g)+3H2(g)2NH3(g)ΔH<0,加压、降温、减小NH3的浓度均有利于平衡向正反应方向移动,②、④正确;将原料气循环利用也可提高原料的转化率,⑤正确。5.外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B3D中产物D的浓度随时间变化的关系如图。则下列有关说法正确的是(C)A.pH=8.8时,升高温度,反应速率不变B.保持外界条件不变,反应一段时间后,pH越小,D的浓度越大C.为了实验取样,可采用调节pH的方法迅速停止反应D.减小外界压强,反应速率一定减小解析:pH=8.8时,升高温度,反应速率一定增大,A项错误;保持外界条件不变,反应一段时间后,pH=7.5和pH=8.2时,有可能D的浓度相同,B项错误;当pH=8.8时,c(D)基本不变,反应速率接近于0,说明反应停止,C项正确;没有气体参加的反应,减小压强对反应速率几乎没有影响,D项错误。6.在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O22NO,经测定前3s用N2表示的反应速率为0.1mol·L-1·s-1,则6s末NO的浓度为(B)A.1.2mol·L-1B.小于1.2mol·L-1C.大于1.2mol·L-1D.不能确定解析:前3s用N2表示的反应速率为0.1mol·L-1·s-1,即用NO表示的反应速率为0.2mol·L-1·s-1。如果3~6s的反应速率仍为0.2mol·L-1·s-1,则6s末NO的浓度为1.2mol·L-1。由于随着反应进行,反应物浓度减小,反应速率减慢,故6s末NO的浓度小于1.2mol·L-1。二、非选择题7.在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)2SO3(g)。(1)降低温度,化学反应速率(填“增大”“减小”或“不变”)。(2)600℃时,在一容积为2L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10min和20min时,分别改变了影响反应的一个条件,反应过程中SO2、O2、SO3的物质的量变化如图所示,前10min正反应速率逐渐(填“增大”“减小”或“不变”);前15min内用SO3表示平均反应速率为。(3)图中反应进程,表示正反应速率与逆反应速率相等的时间段是。(4)根据图示判断,10min时改变的反应条件可能是(填字母,下同);20min时改变的反应条件可能是。a.加...