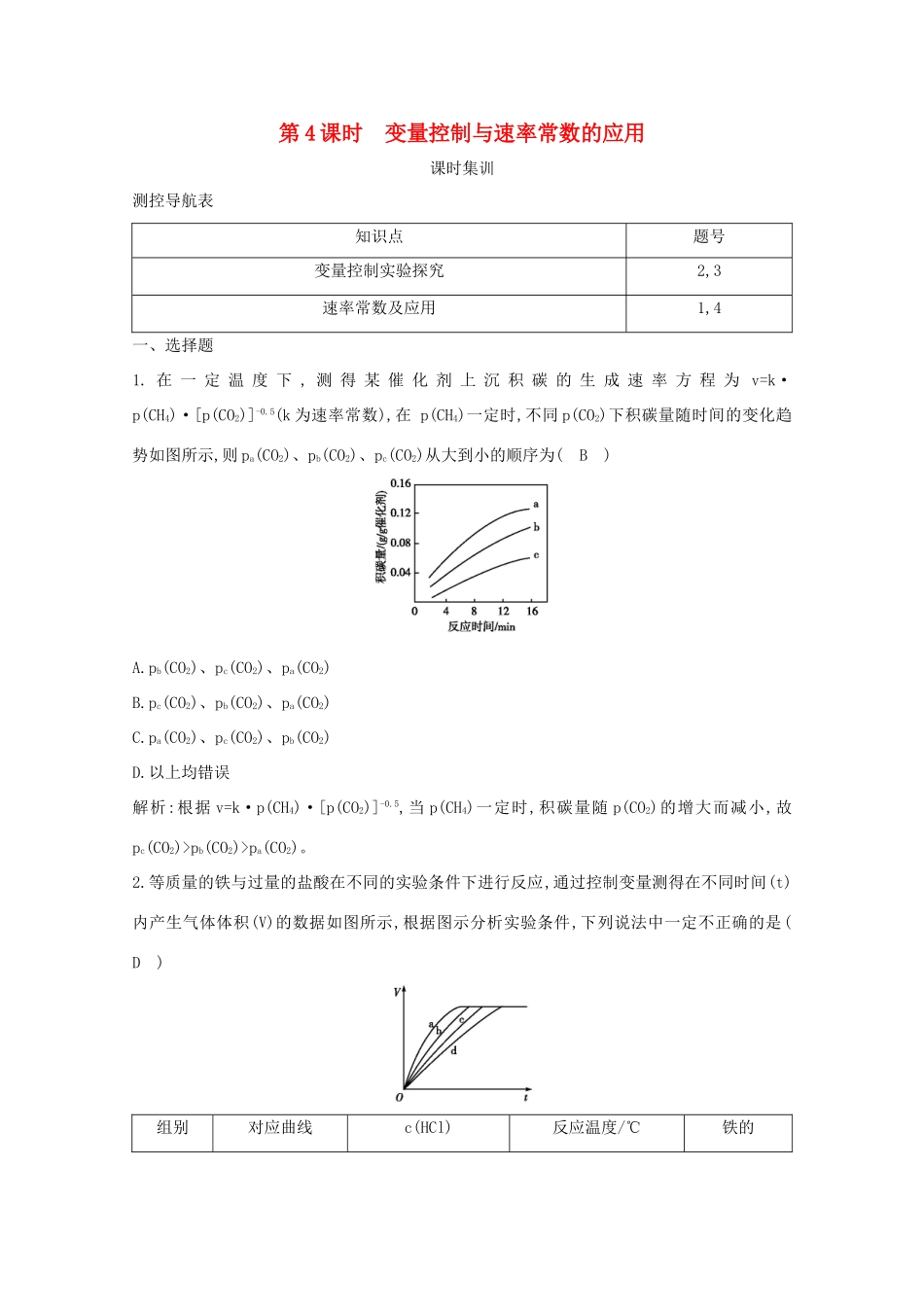
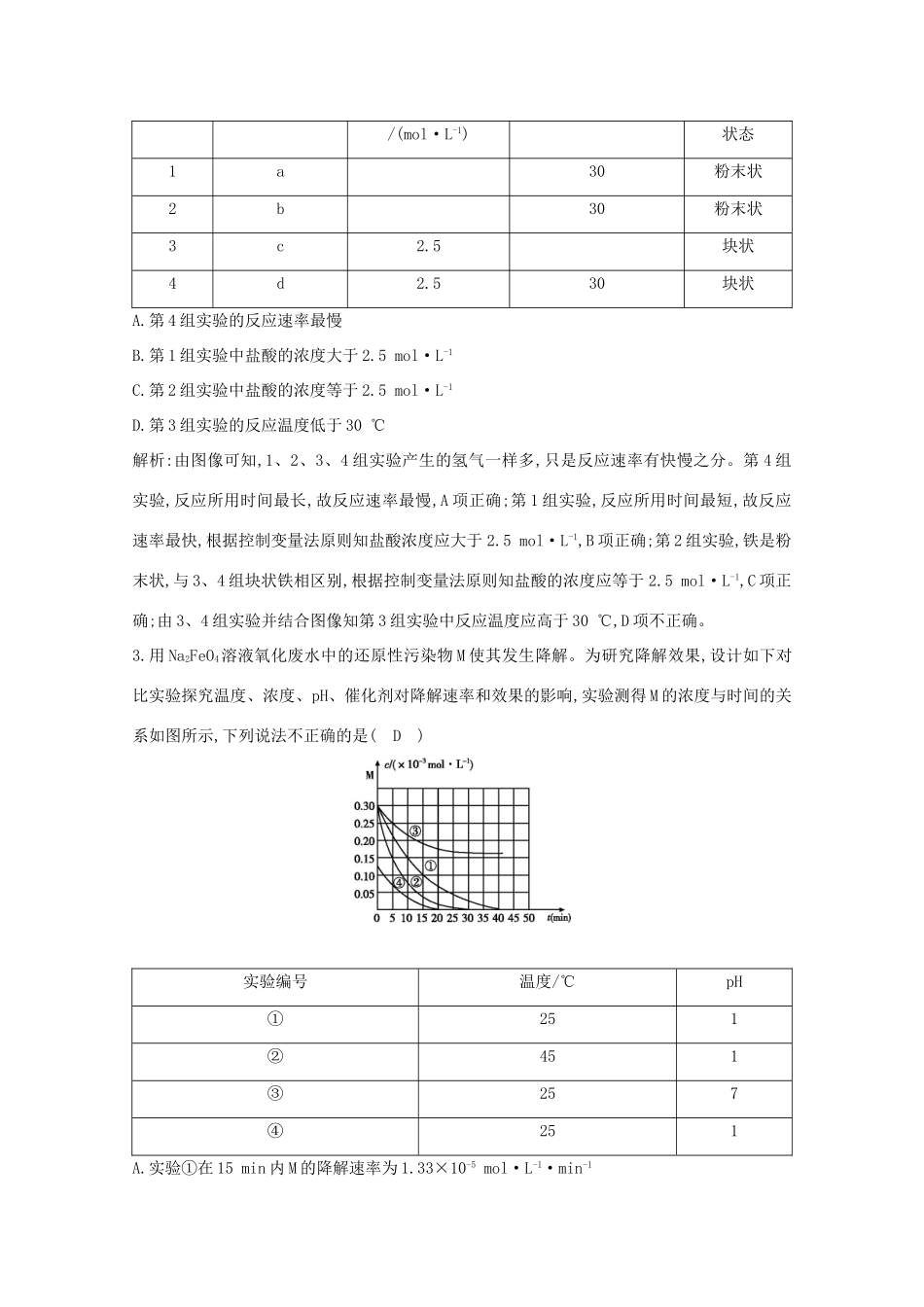
第4课时变量控制与速率常数的应用课时集训测控导航表知识点题号变量控制实验探究2,3速率常数及应用1,4一、选择题1.在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数),在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为(B)A.pb(CO2)、pc(CO2)、pa(CO2)B.pc(CO2)、pb(CO2)、pa(CO2)C.pa(CO2)、pc(CO2)、pb(CO2)D.以上均错误解析:根据v=k·p(CH4)·[p(CO2)]-0.5,当p(CH4)一定时,积碳量随p(CO2)的增大而减小,故pc(CO2)>pb(CO2)>pa(CO2)。2.等质量的铁与过量的盐酸在不同的实验条件下进行反应,通过控制变量测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是(D)组别对应曲线c(HCl)反应温度/℃铁的/(mol·L-1)状态1a30粉末状2b30粉末状3c2.5块状4d2.530块状A.第4组实验的反应速率最慢B.第1组实验中盐酸的浓度大于2.5mol·L-1C.第2组实验中盐酸的浓度等于2.5mol·L-1D.第3组实验的反应温度低于30℃解析:由图像可知,1、2、3、4组实验产生的氢气一样多,只是反应速率有快慢之分。第4组实验,反应所用时间最长,故反应速率最慢,A项正确;第1组实验,反应所用时间最短,故反应速率最快,根据控制变量法原则知盐酸浓度应大于2.5mol·L-1,B项正确;第2组实验,铁是粉末状,与3、4组块状铁相区别,根据控制变量法原则知盐酸的浓度应等于2.5mol·L-1,C项正确;由3、4组实验并结合图像知第3组实验中反应温度应高于30℃,D项不正确。3.用Na2FeO4溶液氧化废水中的还原性污染物M使其发生降解。为研究降解效果,设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间的关系如图所示,下列说法不正确的是(D)实验编号温度/℃pH①251②451③257④251A.实验①在15min内M的降解速率为1.33×10-5mol·L-1·min-1B.若其他条件相同,实验①②说明升高温度,M降解速率增大C.若其他条件相同,实验①③证明pH越高,越不利于M的降解D.实验④说明M的浓度越小,降解的速率越快解析:根据化学反应速率的数学表达式,v(M)=mol·L-1·min-1≈1.33×10-5mol·L-1·min-1,A项正确;实验①②不同的是温度,②的温度高于①,在相同的时间段内,②中M的浓度变化大于①,说明②中M的降解速率大,B项正确;实验①③温度相同,③的pH大于①,在相同的时间段内,①中M浓度变化大于③,说明①的降解速率大于③,C项正确;实验①④中M的浓度不同,0~15min时间段内,④中M浓度变化小于①,说明M的浓度越小,降解速率越慢,D项不正确。二、非选择题4.(1)在2L密闭容器中通入3molH2和1molN2,测得不同温度下,NH3的产率随时间变化如图所示。①T1温度时,0~15min内v(H2)=mol·L-1·min-1。②已知:瞬时速率表达式v正=k正c3(H2)c(N2),v逆=k逆c2(NH3)(k为速率常数,只与温度有关)。温度由T1调到T2,活化分子百分率(填“增大”“减小”或“不变”),k正增大倍数(填“大于”“小于”或“等于”)k逆增大倍数。T1℃时,k正/k逆=。(2)已知在一定温度下的可逆反应N2O4(g)2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=k逆。升高温度,k正增大的倍数(填“大于”“小于”或“等于”)k逆增大的倍数。(3)实验测得反应2NO(g)+O2(g)2NO2(g)ΔH<0的即时速率满足以下关系式:v正=k正·c2(NO)·c(O2),v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响。①温度为T1时,在1L的恒容密闭容器中,投入0.6molNO和0.3molO2达到平衡时O2为0.2mol;温度为T2时,该反应存在k正=k逆,则T1(填“大于”“小于”或“等于”)T2。②研究发现该反应按如下步骤进行:第一步:NO+NON2O2快速平衡第二步:N2O2+O22NO2慢反应其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正c2(NO),v1逆=k1逆c(N2O2)。下列叙述正确的是。(填字母)A.同一温度下,平衡时第一步反应的k1正/k1逆越大反应正向程度越大B.第二步反应速率低,因而转化率也低C.第二步的活化能比第一步的活化能低D.整个反应的速率由第二步反应速率决定解析:(1)①T1温度下,15min时,NH3的产率达50%,反应n(H2)=1.5mol,v(H2)===...