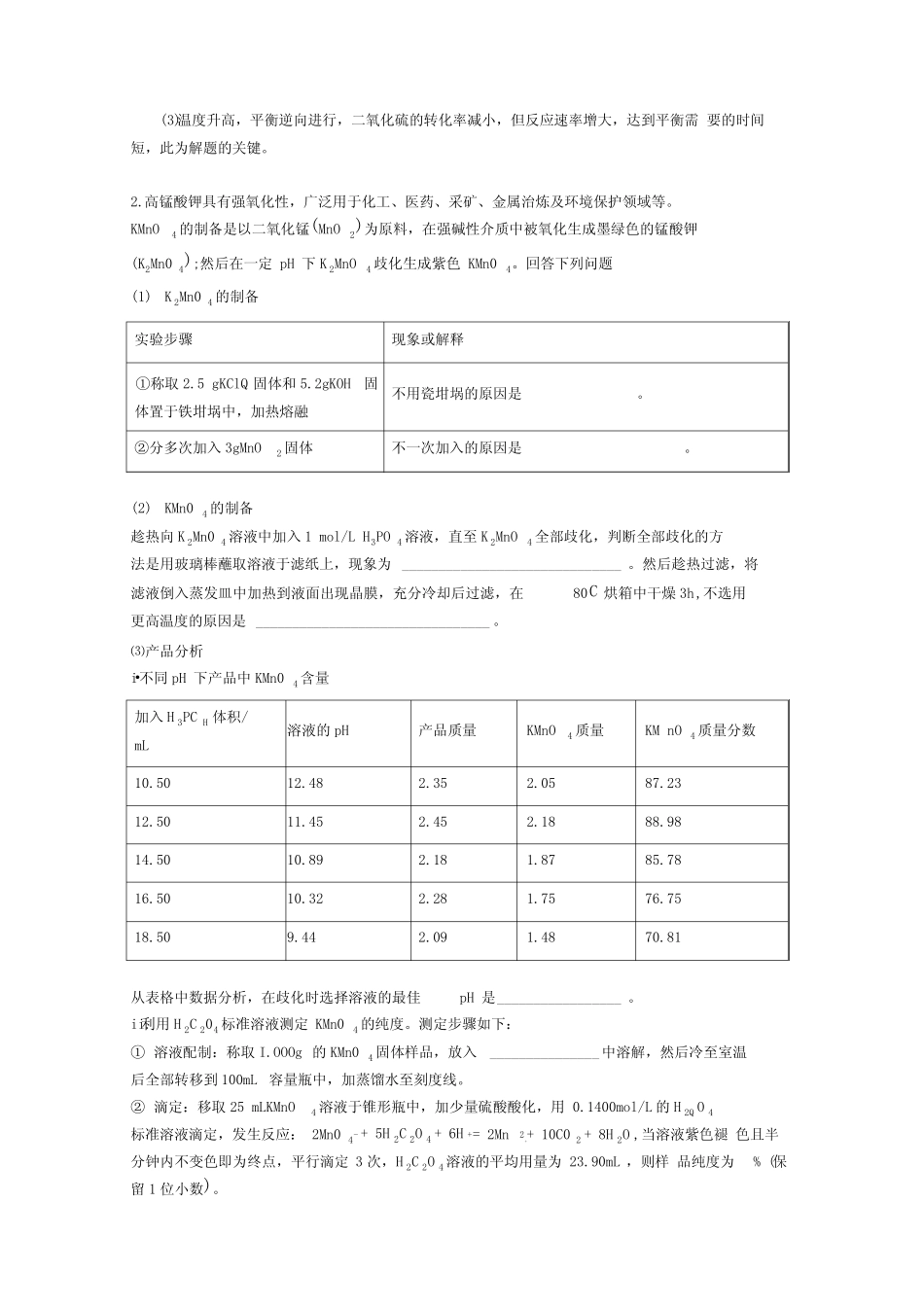
全国高考化学化学反应速率与化学平衡的综合高考真题汇总含详细答案一、化学反应速率与化学平衡1根据当地资源等情况,硫酸工业常用黄铁矿空:(1)将0.050molS02(g)和0.030molO2(g)充入一个2L的密闭容器中,在一定条件下发生反应:2SQ(g)+O2(g)?2SO3(g)+Q。经2分钟反应达到平衡,测得n(S03)=0.040mol,贝U02的平均反应速率为_______(2)在容积不变时,下列措施中有利于提高S02平衡转化率的有_______(选填编号)a•移出氧气b降低温度c.减小压强d再充入0.050molS02(g)和0.030mol02(g)⑶在起始温度Ti(673K)时S02的转化率随反应时间⑴的变化如图,请在图中画出其他条件不变情况下,起始温度为T2(723K)时SQ的转化率随反应时间变化的示意图___(4)黄铁矿在一定条件下煅烧的产物为SQ和F&O4①将黄铁矿的煅烧产物FesO4溶于H2SQ后,加入铁粉,可制备FeSQ。酸溶过程中需维持溶液有足够的酸性,其原因是________②FeS?能将溶液中的Fe3+还原为Fe2+,本身被氧化为SQ2「。写出有关的离子方程式。有2mol氧化产物生成时转移的电子数为制Fe3+与FW+的水解,并防止Fe^+被氧化成Fe3+FeS+14Fe3++8H2O=15Fe2++2SC42「+16H+14NA【解析】【分析】(主要成分为FeS2)作为原料。完成下列填【答案】0.005mol/(L?min)bd转ft/%010»3444»»抑c(1)根据v=求出氧气的速率,然后根据速率之比等于对应物质的化学计量数之比计算;(2)反应放热,为提高SQ平衡转化率,应使平衡向正反应方向移动,可降低温度,体积不变,不能从压强的角度考虑,催化剂不影响平衡移动,移出氧气,平衡向逆反应方向移动,不利于提高SQ平衡转化率,由此分析解答;(3)反应是放热反应,温度升高,平衡逆向进行,二氧化硫的转化率减小,但达到平衡所需要的时间缩短,据此画出曲线;⑷①Fe3+与Fe2+易水解,FW*易被氧化成Fe3*;②根据氧化还原反应中的反应物和生成物几何电子守恒来配平化学方程式,结合方程计算转移电子数。【详解】c°.°伽011(1)v(SO3)==2L=0.01mol/(L?min),所以v(C>2)=v(SQ)=0.005mol/(L?min),t2故答案为:0.005mol/(L?min);(2)a•移出氧气,平衡逆向移动,二氧化硫的转化率减少,故不选;b.降低温度,平衡正向移动,二氧化硫的转化率增大,故选;c.减小压强,平衡逆向移动,二氧化硫的转化率减少,故不选;d.再充入0.050molSO2(g)和0.030molO2(g),相当于增大压强,平衡正向移动,二氧化硫的转化率增大,故选;故答案为:bd;⑶反应:2SQ(g)+O2(g)?2SQ(g)AHv0,SQ的转化率在起始温度T1=673K下随反应时间(t)的变化如图,其他条件不变,仅改变起始温度为T2=723K,温度升高,平衡逆向进行,二氧化硫的转化率减小,但反应速率增大,达到平衡需要的时间短,在图中画出温度T2下⑷①Fe2O3(或Fe3O4等)溶于H2SQ后,生成的FeT与Fe2+易水解,Fe2+易被氧化成Fe3*,所以要加入Fe粉和酸,抑制Fe3*与Fe2*的水解,并防止Fe2*被氧化成Fe3*,故答案为:抑制Fe3*与Fe2*的水解,并防止Fe2*被氧化成Fe3*;②-2价的硫离子具有还原性,FeS可以将溶液中的Fe3+还原为Fe2+,而本身被氧化为硫酸根离子,有关的离子方程式为:FeS+14Fe3++8H2O=15Fe2++2SC42+16H+,氧化产物是硫酸根离子,有2mol硫酸根生成时转移的电子数为14NA,故答案为:FeS>+14Fe3++8H2O=15Fe2++2SC42「+16H+;14NAO【点睛】Heo——T,30}r—Ahr:.<■-”...............*;故答案为:40*Zl「/1f2Q-:/20L//-#/-11111111iii11t11SQ的转化率随反应时间变化的预期结果示意图如图所示T.T.(3)温度升高,平衡逆向进行,二氧化硫的转化率减小,但反应速率增大,达到平衡需要的时间短,此为解题的关键。2.高锰酸钾具有强氧化性,广泛用于化工、医药、采矿、金属治炼及环境保护领域等。KMnO4的制备是以二氧化锰(MnO2)为原料,在强碱性介质中被氧化生成墨绿色的锰酸钾(K2Mn04);然后在一定pH下K2MnO4歧化生成紫色KMn04。回答下列问题(1)K2Mn04的制备实验步骤现象或解释①称取2.5gKClQ固体和5.2gKOH固体置于铁坩埚中,加热熔融不用瓷坩埚的原因是。②分多次加入3gMnO2固体不一次加入的原因是。(2)KMn04的制备趁热向K2Mn04溶液中加入1mol/LH3PO4溶液,直至K2MnO4全部歧化,判断全部歧化的方...