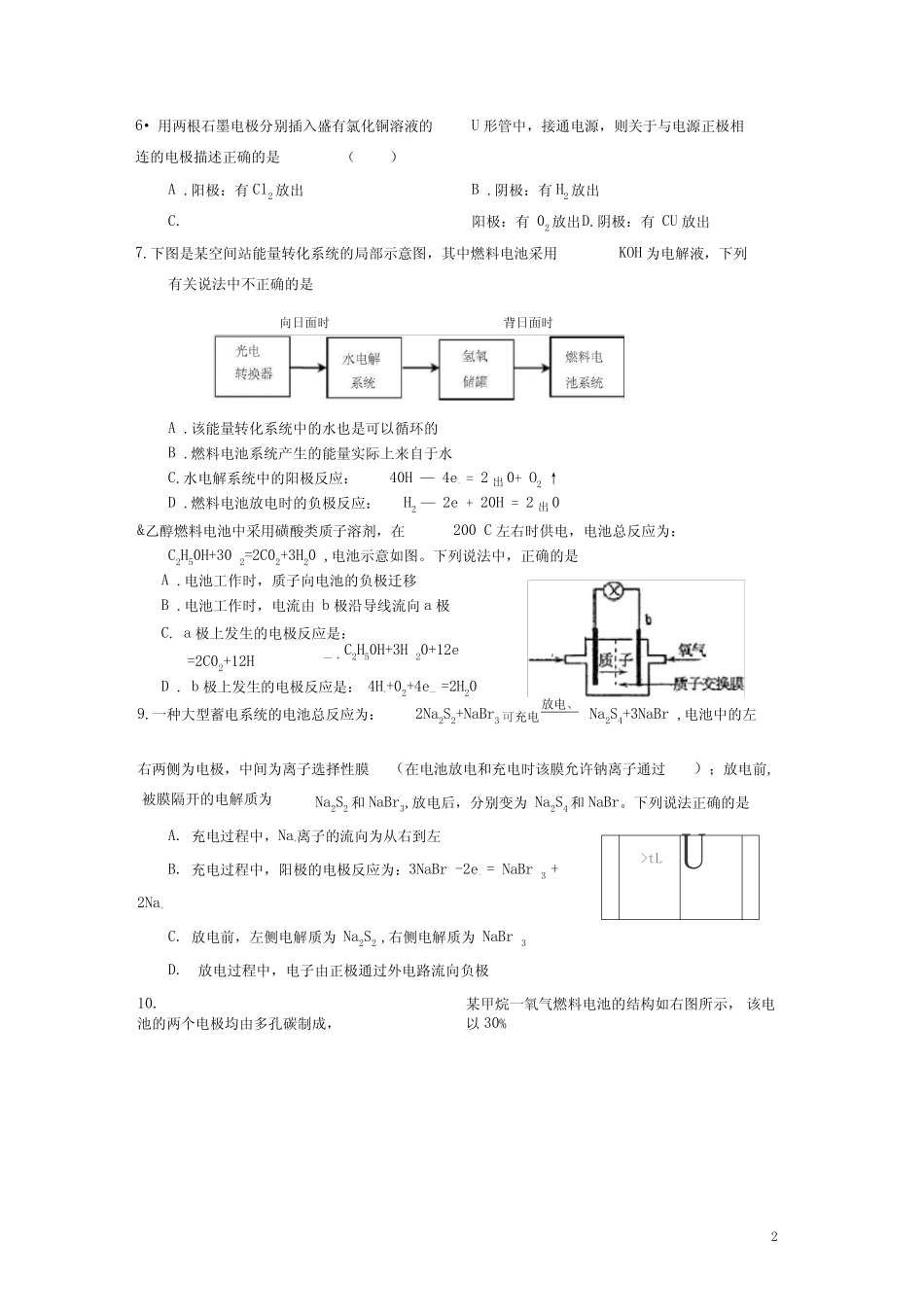
1高三、一轮复习专题练习----化学反应原理.化学反应与能量转化1.在下列各说法中,正确的是()A.热化学方程式中的化学计量数表示物质的量,可以是分数B.△H>0表示放热反应,△HVO表示吸热反应C.lmolH2SO4与ImolBa(OH)2反应生成BaS04沉淀时放出的热叫做中和热D.1molH2与0.5molO2反应放出的热就是H2的燃烧热2.已知25C、IOIkPa条件下:-AkS)÷3(⅜CgJ==EAl1O1CS)i∆W--2834.9kJ・moΓi⅛AKs)+2CX(g)—'2ALOsbD.金刚石比石墨稳定4.在理论上不能用于设计原电池的化学反应是A.H2SO4(aq)+BaC∣2(aq)=2HCl(aq)+BaSO4(s);△HV0⅛⅛⅛B.CH3CH2OH(l)+3O2(g)>2CO2(g)+3H2O(l);△HV0C.4FeOH2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s);△HV0D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g)+4H2O(l);△HV05.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放放电、电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2OP充电3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是A.放电时负极反应为:Zn—2e—+2OH—=Zn(OH)2——2B.充电时阳极反应为:Fe(OH)3—3e+5OH=FeO4+4H2OC.放电时每转移3mol电子,正极有1molK2FeO4被氧化D.放电时正极附近溶液的碱性增强3.已知C(金刚石,高温、隔绝空气S)-■高温、超高压、隔绝空气C(石墨,S);△H=—1.89KJ∕mol26•用两根石墨电极分别插入盛有氯化铜溶液的U形管中,接通电源,则关于与电源正极相连的电极描述正确的是()A.阳极:有Cl2放出B.阴极:有H2放出C.阳极:有02放出D.阴极:有CU放出7.下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是A.该能量转化系统中的水也是可以循环的B.燃料电池系统产生的能量实际上来自于水C.水电解系统中的阳极反应:40H—4e-=2出0+O2↑D.燃料电池放电时的负极反应:H2—2e+20H=2出0&乙醇燃料电池中采用磺酸类质子溶剂,在200C左右时供电,电池总反应为:C2H50H+302=2C02+3H20,电池示意如图。下列说法中,正确的是A.电池工作时,质子向电池的负极迁移B.电池工作时,电流由b极沿导线流向a极C.a极上发生的电极反应是:—+C2H50H+3H20+12e=2C02+12HD.b极上发生的电极反应是:4H++02+4e—=2H20放电、9.一种大型蓄电系统的电池总反应为:2Na2S2+NaBr3可充电Na2S4+3NaBr,电池中的左右两侧为电极,中间为离子选择性膜(在电池放电和充电时该膜允许钠离子通过);放电前,Na2S2和NaBr3,放电后,分别变为Na2S4和NaBr。下列说法正确的是A.充电过程中,Na+离子的流向为从右到左B.充电过程中,阳极的电极反应为:3NaBr-2e-=NaBr3+2Na+C.放电前,左侧电解质为Na2S2,右侧电解质为NaBr3D.放电过程中,电子由正极通过外电路流向负极10.某甲烷一氧气燃料电池的结构如右图所示,该电池的两个电极均由多孔碳制成,以30%>tLU被膜隔开的电解质为向日面时背日面时3KOH溶液为电解质溶液,气体由多孔碳隙逸出并在电极表面放电,其总反应的化学方程式为CH4+2O2+2KOH=K2CO3+3H2O。下列说法正确的是A.CH4极是电源的正极放电材料4B.若b处通人的气体为氧气,则B极为正极C.若有2mol电子发生转移,则消耗的O2为5.6L(标准状况)D.放电一段时间后正极附近溶液的C(H+)增大11.如图:X为单质硅,Y为金属铁,a为NaoH溶液,按图组装一个原电池,下列说法正确的是:A.X为负极,电极反应为:Si—4e-=Si4+B.X为正极,电极反应为:4H2O+4e-=4OH-+2H2↑C.X为负极,电极反应为:Si+6OH-—4e-=SiO32-+3H2θD.Y为负极,电极反应为:Fe—2e'=Fe2+12.已知:在热力学标准态(298K、1.01×05Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。据示意图。试回答下列问题:(1)写出氧族元素中含有18e-的两种氢化物的电子式_____________________________。(2)请你归纳:非...