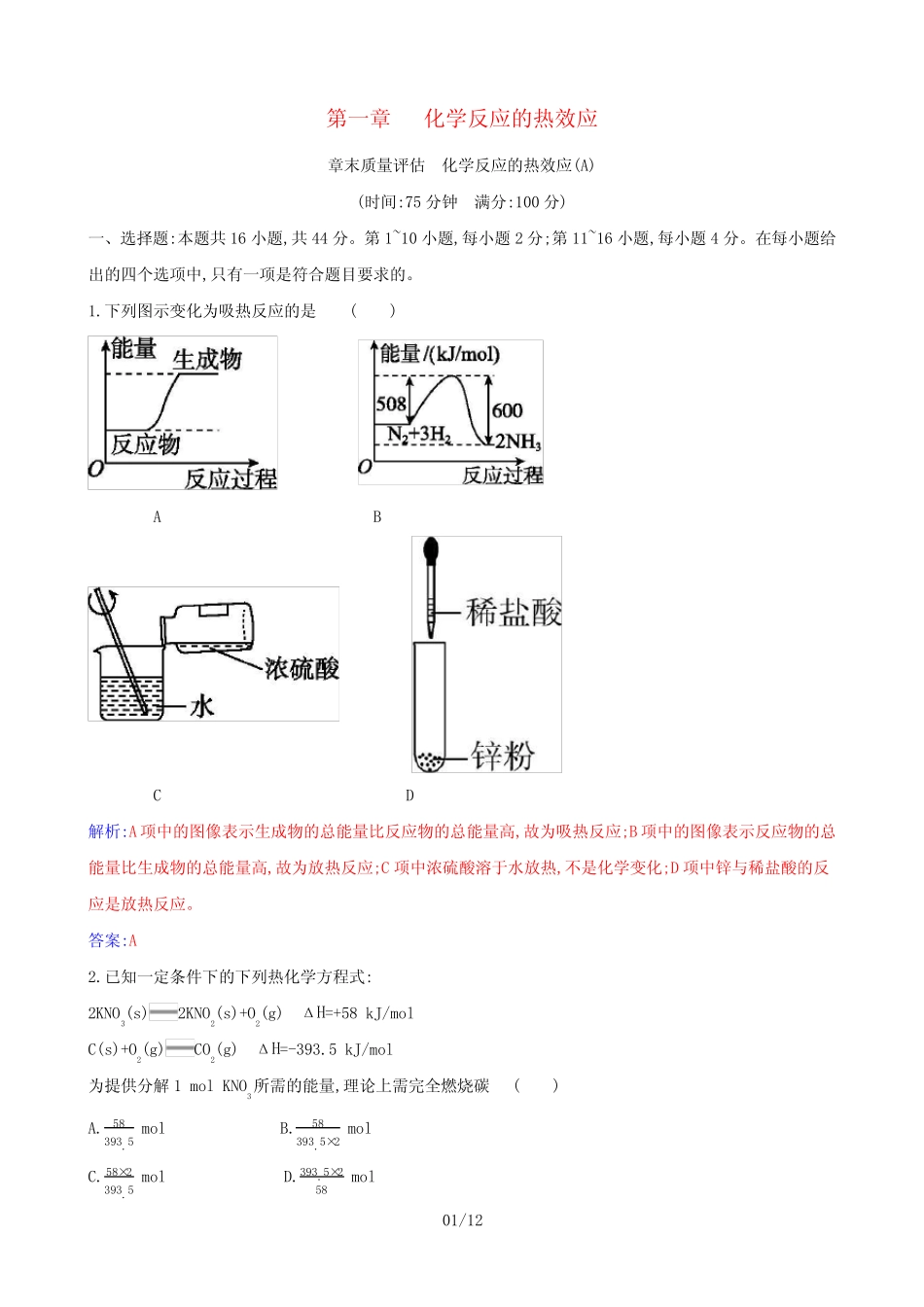
01/12第一章化学反应的热效应章末质量评估化学反应的热效应(A)(时间:75分钟满分:100分)一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。1.下列图示变化为吸热反应的是()ABCD解析:A项中的图像表示生成物的总能量比反应物的总能量高,故为吸热反应;B项中的图像表示反应物的总能量比生成物的总能量高,故为放热反应;C项中浓硫酸溶于水放热,不是化学变化;D项中锌与稀盐酸的反应是放热反应。答案:A2.已知一定条件下的下列热化学方程式:2KNO3(s)2KNO2(s)+O2(g)ΔH=+58kJ/molC(s)+O2(g)CO2(g)ΔH=-393.5kJ/mol为提供分解1molKNO3所需的能量,理论上需完全燃烧碳()A.58393.5molB.58393.5×2molC.58×2393.5molD.393.5×258mol02/12解析:依据反应2KNO3(s)2KNO2(s)+O2(g)ΔH=+58kJ/mol,分解1molKNO3所需要吸收的热量为582kJ;提供582kJ热量需要燃烧碳的物质的量为58393.5×2mol。答案:B3.含1molBa(OH)2的稀溶液与足量稀盐酸反应,放出热量114.6kJ。表示生成1molH2O的热化学方程式是()A.Ba(OH)2(aq)+2HCl(aq)BaCl2(aq)+2H2O(l)ΔH=+114.6kJ·mol-1B.Ba(OH)2(aq)+2HCl(aq)BaCl2(aq)+2H2O(l)ΔH=-114.6kJ·mol-1C.Ba12(OH)2(aq)+HCl(aq)12BaCl2(aq)+H2O(l)ΔH=-57.3kJ·mol-1D.Ba12(OH)2(aq)+HCl(aq)12BaCl2(aq)+H2O(l)ΔH=+57.3kJ·mol-1解析:强酸稀溶液与强碱稀溶液发生中和反应,每生成1molH2O,放出热量57.3kJ。根据书写热化学方程式的要求判断,C项符合题意。答案:C4.甲烷与CO2可用于制取合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)2CO(g)+2H2(g),1gCH4(g)完全反应可释放15.46kJ的热量。下列能表示该反应过程的能量变化的是()ABCD解析:1gCH4完全反应释放15.46kJ的热量,则1molCH4完全反应释放的热量为247.36kJ。答案:D5.实验表明,在一定条件下,乙烯与水的反应可表示为C2H4(g)+H2O(g)C2H5OH(g)ΔH=-45.8kJ/mol。则下列说法中正确的是()A.实验中,乙烯的用量不会影响该反应的焓变(ΔH)03/12B.该反应中0.5molH2O(l)完全反应放出的热量为22.9kJC.1molC2H5OH(g)具有的能量大于1molC2H4(g)和1molH2O(g)所具有的能量和D.1molC2H4(g)和1molH2O(g)中化学键的总键能大于1molC2H5OH(g)中化学键的总键能解析:该反应中0.5molH2O(g)完全反应放出的热量为22.9kJ,B项错误;放热反应,反应物总能量大于生成物总能量,生成物的总键能大于反应物的总键能,C、D项错误。解析:A6.单斜硫和正交硫转化为二氧化硫的能量变化如图所示。下列说法正确的是()A.S(单斜,s)S(正交,s)ΔH=+0.33kJ·mol-1B.正交硫比单斜硫稳定C.相同物质的量的正交硫比单斜硫含有的能量高D.①的热化学方程式可表示断裂1molO2中的共价键吸收的能量比形成1molSO2中的共价键放出的能量少298.16kJ解析:A项,单斜硫的能量比正交硫的能量高,S(单斜,s)S(正交,s)ΔH=-0.33kJ·mol-1,为放热反应,错误;B项,物质的能量越高越不稳定,则正交硫比单斜硫稳定,正确;C项,由图像可以看出,相同物质的量的单斜硫的能量比正交硫的能量高,错误;D项,①的反应需断裂单斜硫中S—S键和OO键,不仅仅是断裂1molO2中的共价键吸收能量,错误。答案:B7.已知反应H2(g)+I2(g)2HI(g),1molH2完全反应放出akJ的热量,依据下表数据,下列说法中错误的是()化学键H—HI—I断开1mol化学键时吸收的能量/kJbcA.该反应中反应物的总能量大于生成物的总能量B.断开1molH—H和1molI—I所需能量大于断开2molH—I所需能量04/12C.断开2molH—I所需能量为(a+b+c)kJD.向密闭容器中加入2molH2与2molI2,充分反应后放出的热量小于2akJ解析:A项,此反应是放热反应,即反应物的总能量大于生成物的总能量,正确;B项,此反应为放热反应,断开1molH—H和1molI—I所需能量小于断开2molH—I所需能量,错误;C项,断开1molH—H和1molI—I所需能量为(b+c)kJ,设断开2molH—I所需能量为xkJ,此反应属于放热反应,x-(b+c)=a,则x=a+b+c,正确;D项,此反应属于可逆反应,不能进行到底,正确。答案:B8.向盛有50mL1.00mol/L盐酸的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示。下列说法中不正确的是()A.该实验表明化...