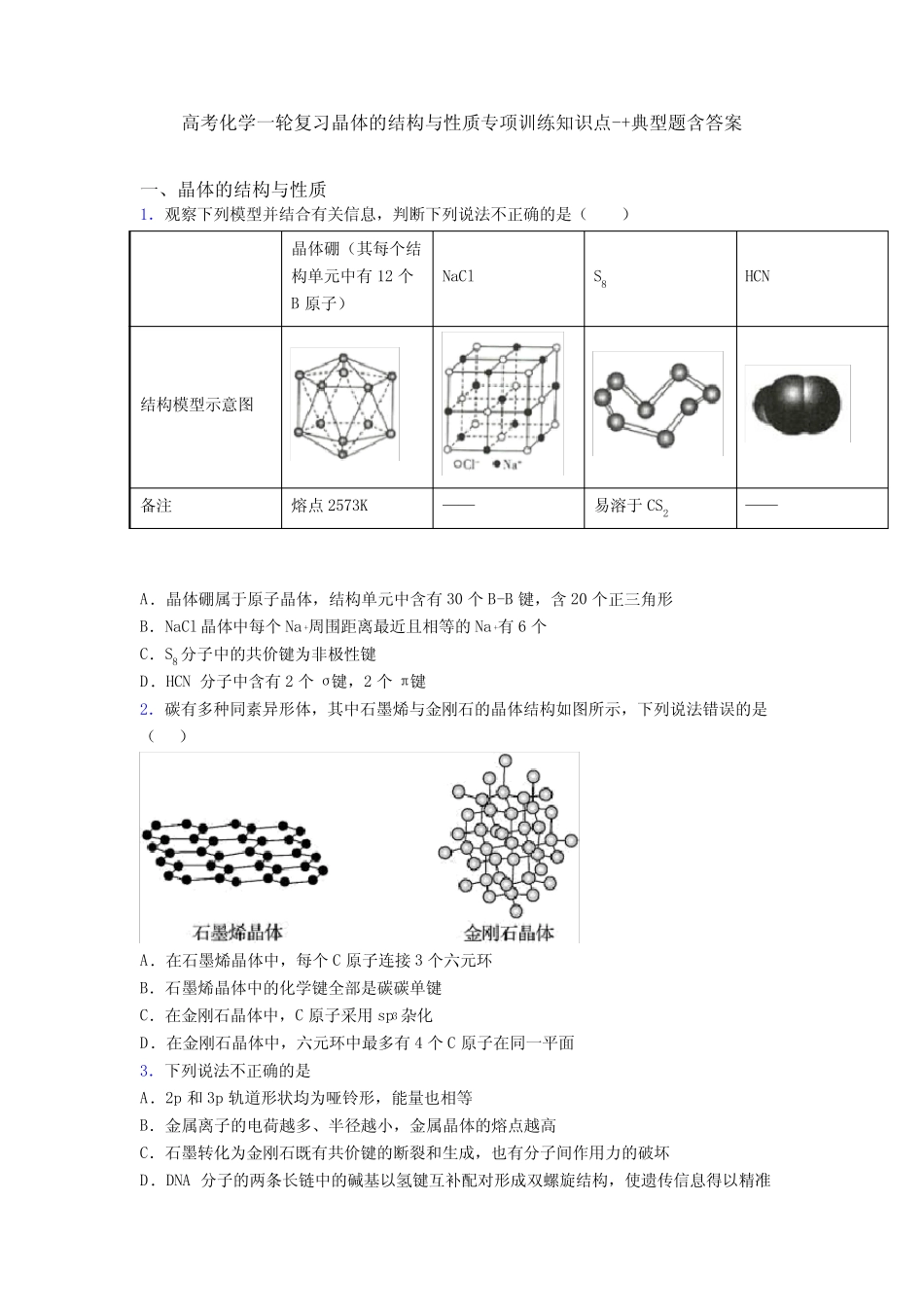
高考化学一轮复习晶体的结构与性质专项训练知识点-+典型题含答案一、晶体的结构与性质1.观察下列模型并结合有关信息,判断下列说法不正确的是()晶体硼(其每个结构单元中有12个B原子)NaClS8HCN结构模型示意图备注熔点2573K——易溶于CS2——A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个C.S8分子中的共价键为非极性键D.HCN分子中含有2个σ键,2个π键2.碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,下列说法错误的是()A.在石墨烯晶体中,每个C原子连接3个六元环B.石墨烯晶体中的化学键全部是碳碳单键C.在金刚石晶体中,C原子采用sp3杂化D.在金刚石晶体中,六元环中最多有4个C原子在同一平面3.下列说法不正确的是A.2p和3p轨道形状均为哑铃形,能量也相等B.金属离子的电荷越多、半径越小,金属晶体的熔点越高C.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏D.DNA分子的两条长链中的碱基以氢键互补配对形成双螺旋结构,使遗传信息得以精准复制4.晶体是一类非常重要的材料,在很多领域都有广泛的应用。我国现已能够拉制出直径为300mm、重达81kg的大直径硅单晶,晶体硅大量用于电子产业。下列叙述正确的是()A.形成晶体硅的速率越快越好B.晶体硅有固定的熔沸点,研碎后就变成了非晶体C.可用X射线衍射实验来鉴别晶体硅和玻璃D.晶体硅的形成与晶体的自范性有关,而与各向异性无关5.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是A.该晶体属于原子晶体,其熔、沸点很高B.该晶体中每个碳原子上连有4个氮原子,每个氮原子连接3个碳原子C.该晶体中碳原子和氮原子都满足最外层8电子结构D.该晶体的结构与金刚石类似,都是原子间以非极性键形成的空间网状结构6.下列表述不正确的是()A.熔点:CF4碳化硅>晶体硅C.晶格能:NaF>NaCl>NaBr>NalD.熔点:Na>Mg>Al7.下列说法正确的是()A.熔点:锂<钠<钾<铷<铯B.由于HCl的分子间作用力比HI的强,故HC1比HI稳定C.等质量的金刚石和石墨晶体所含碳碳键的数目相等D.已知离子晶体AB的晶胞如图所示,则每个A+周围距离最近且等距的B-有8个8.根据下表给出的几种物质的熔点、沸点数据,判断下列有关说法中错误的是()晶体NaClKClAlCl3SiCl4单质B熔点/℃810776190﹣682300沸点/℃14651418180572500A.SiCl4是分子晶体B.单质B可能是共价晶体C.AlCl3加热能升华D.NaCl中化学键的强度比KCl中的小9.植物生长除了需要氮、磷、钾三种元素之外,还需要硼、镁等微量元素。有一种硼镁肥料的主要成分是Mg3(BO3)2·2MgSO4·6H2O。回答下列问题:(1)Mg3(BO3)2·2MgSO4·6H2O的氧化物形式为_________,某短周期元素与硼同族,其元素原子的最外层电子排布式为__________;(2)某短周期元素的单质和金属镁可在高温下反应,得到产物A,A与水反应生成两种碱,该元素周期表中的位置为___周期___族,写出A与水反应的化学方程式_______;(3)比较硼和硫的非金属性强弱,硼的非金属性_______硫(填大于或小于),硼元素原子中有______种能量不同的电子;(4)硼单质存在着多种同素异形体,某单质的熔点2300℃,沸点2550℃,原因可能是____。A.硼单质性质与铝相似B.硼在元素周期表中与碳相邻C.硼单质的晶体结构为空间网状结构D.硼元素存在着几种同位素,其中10B可用于原子反应堆10.海水是资源宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。完成下列填空:(1)氯离子原子核外有_____种不同运动状态的电子、有____种不同能量的电子。(2)溴在周期表中的位置_________。(3)卤素单质及其化合物在许多性质上都存在递变规律,请说明下列递变规律的原因。①熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是______________。②还原性按Cl—、Br—、I—的顺序依次增大,原因是____________。(4)已知X2(g)+H2(g)2HX(g)+Q(X2表示Cl2、Br2),如图表示上述反应的平衡常数K与温度T的关系。①Q表示X2(g)与H2(g)反应的反应热,Q_____0(...