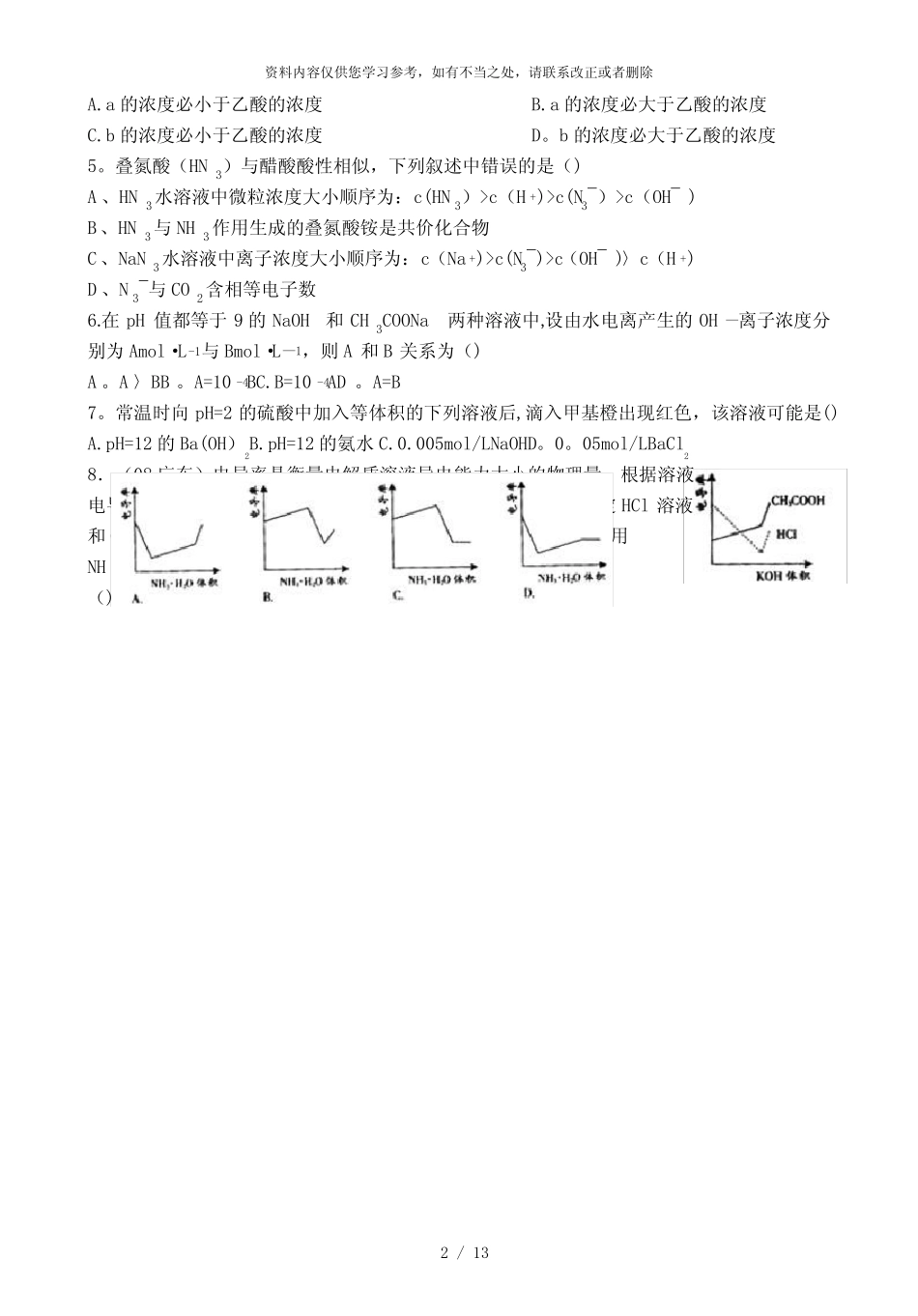
资料内容仅供您学习参考,如有不当之处,请联系改正或者删除1/13新人教版高中化学选修四《弱电解质与水的电离》试题精选(一)附答案1.取pH值均等于2的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是()A.醋酸与锌反应放出氢气多B。盐酸和醋酸分别与锌反应放出的氢气一样多C。醋酸与锌反应速率大D.盐酸和醋酸分别与锌反应的速率一样大2。在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是()A。甲烧杯中的酸过量B.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大C。两烧杯中参加反应的锌等量D。反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小3.pH值为4的FeCl3溶液和pH值为10的K2CO3溶液中,水的电离程度分别为α1和α2,则它们的大小关系是()A。α1〉α2B.α1<α2C.α1=α2D。无法判断4.甲酸和乙酸都是弱酸,当它们的浓度均为0。10mol/L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸。经测定它们的pH从大到小依次为a、乙酸、b。由此可知()资料内容仅供您学习参考,如有不当之处,请联系改正或者删除2/13A.a的浓度必小于乙酸的浓度B.a的浓度必大于乙酸的浓度C.b的浓度必小于乙酸的浓度D。b的浓度必大于乙酸的浓度5。叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是()A、HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)B、HN3与NH3作用生成的叠氮酸铵是共价化合物C、NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(OH¯)〉c(H+)D、N3¯与CO2含相等电子数6.在pH值都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH—离子浓度分别为Amol·L-1与Bmol·L—1,则A和B关系为()A。A〉BB。A=10-4BC.B=10-4AD。A=B7。常温时向pH=2的硫酸中加入等体积的下列溶液后,滴入甲基橙出现红色,该溶液可能是()A.pH=12的Ba(OH)2B.pH=12的氨水C.0.005mol/LNaOHD。0。05mol/LBaCl28.(08广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是()资料内容仅供您学习参考,如有不当之处,请联系改正或者删除2/139。25℃时,PH=11的NaOH溶液和NaCN溶液中,由水电离出的c(H+)的关系()A。相等B。后者是前者的11倍C。后者是前者的108D.前者是后者的10810.常温下,某学生用0.1mol·L-1H2SO4溶液滴定0。1mol·L-1NaOH溶液,中和后加水至100mL。若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05mL),则①和②两种情况下所得溶液的pH之差是()A。4B。4.6C。5。4D。611.(06年北京)某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表判断合理的是()编号HXYOH溶液的体积关系①强酸强碱V(HX)=V(YOH)②强酸强碱V(HX)②〉④>③D.①④两溶液等体积混合,所得溶液中c(Cl—)>c(NH4+)〉c(H+)>c(OH-)13.常温下,将PH=1的稀硫酸平均分成两等份,一份加入适量的水,另一份加入与该硫酸溶液物质的量浓度相等的NaOH溶液,两者PH都升高了1,则加入的水和NaOH溶液的体积比为()A。5:1B.6:1C。10:1D.11:114.(09海南)已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误..的是:A.该溶液的pH=4B.升高温度,溶液的pH增大C.此酸的电离平衡常数约为1×10-7D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍15.(09上海)对于常温下...