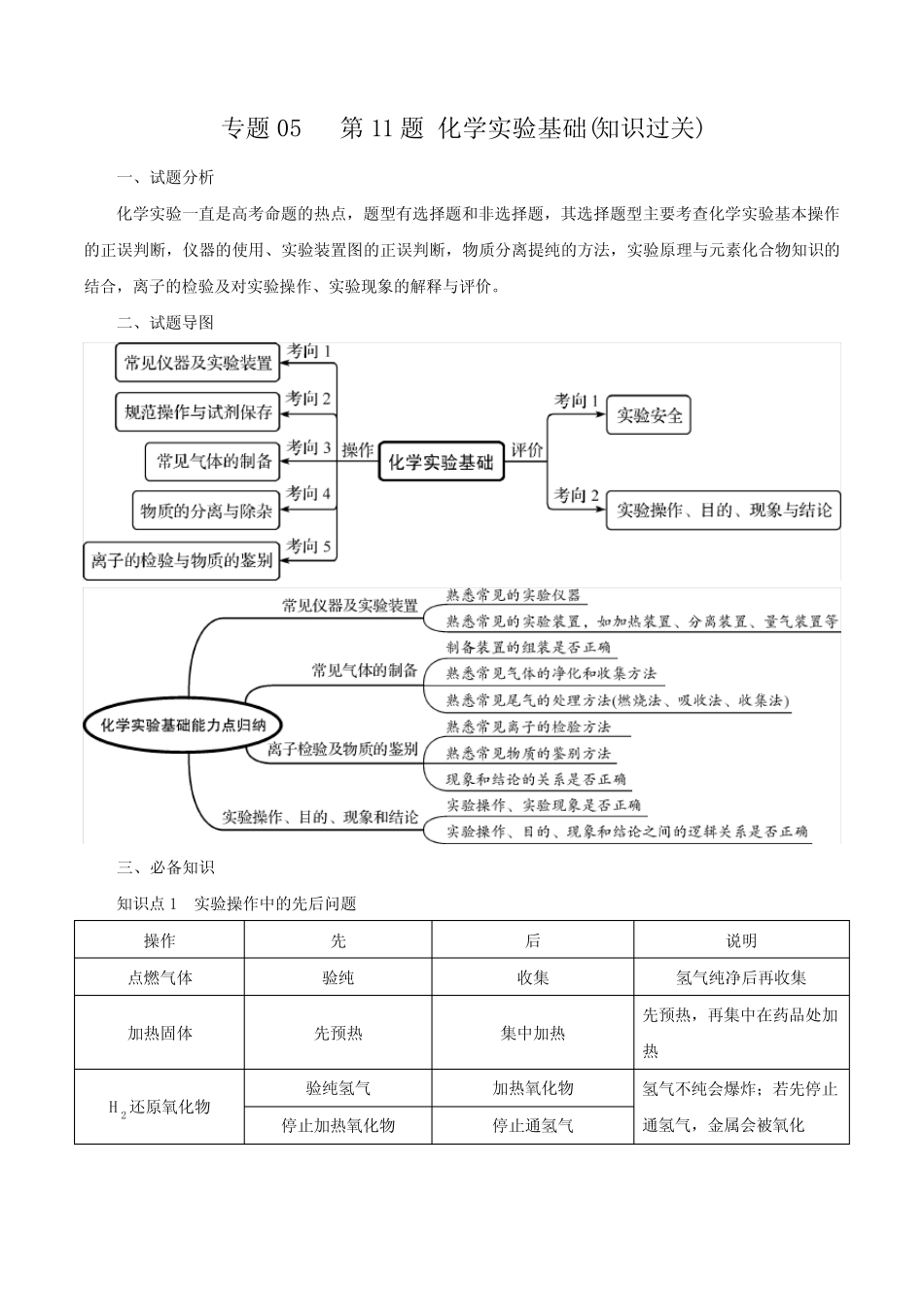
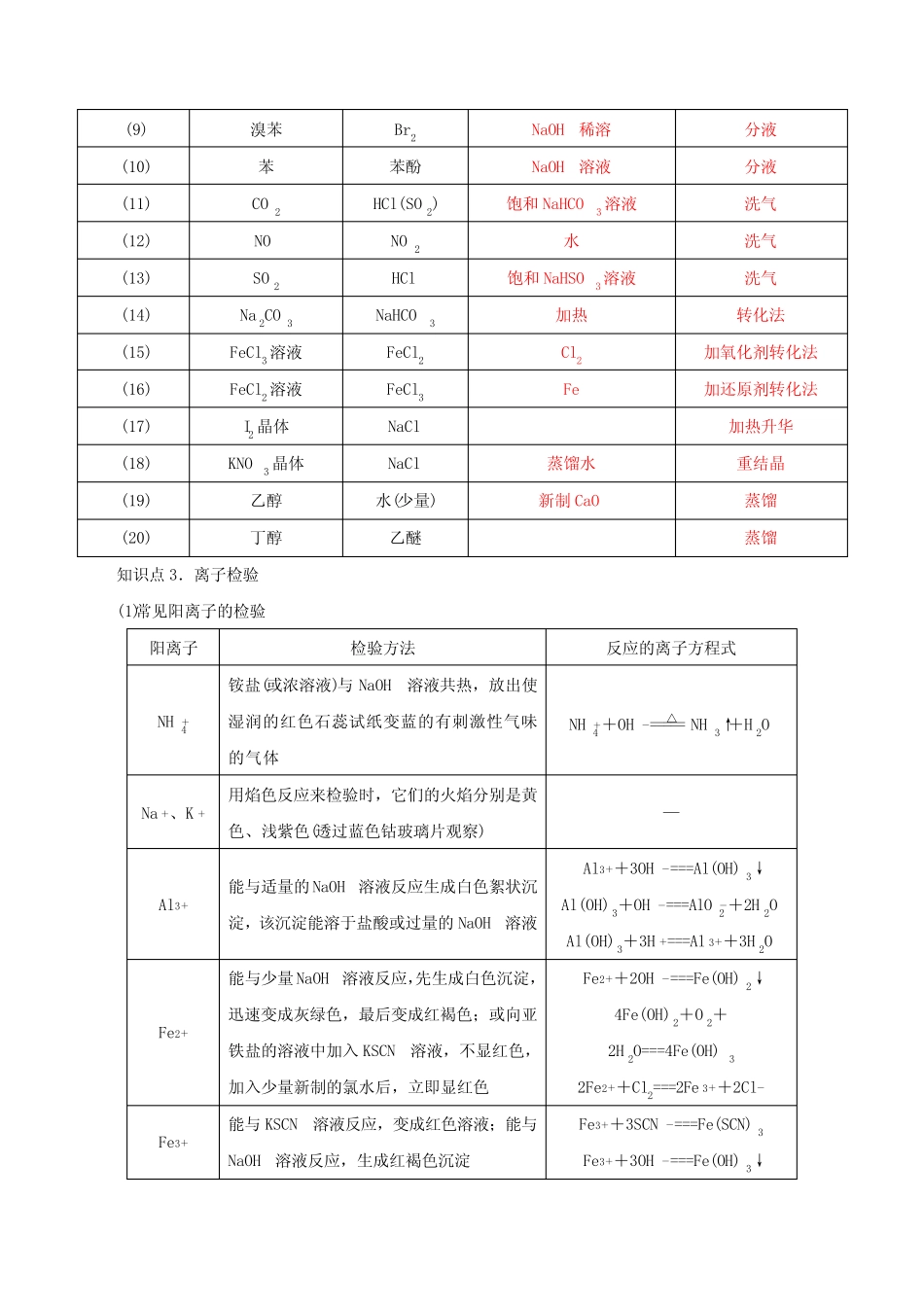
专题05第11题化学实验基础(知识过关)一、试题分析化学实验一直是高考命题的热点,题型有选择题和非选择题,其选择题型主要考查化学实验基本操作的正误判断,仪器的使用、实验装置图的正误判断,物质分离提纯的方法,实验原理与元素化合物知识的结合,离子的检验及对实验操作、实验现象的解释与评价。二、试题导图三、必备知识知识点1实验操作中的先后问题操作先后说明点燃气体验纯收集氢气纯净后再收集加热固体先预热集中加热先预热,再集中在药品处加热H2还原氧化物验纯氢气加热氧化物氢气不纯会爆炸;若先停止通氢气,金属会被氧化停止加热氧化物停止通氢气除去Cl2中HCl和H2O除HCl除H2O先除其他的杂质,最后除去水蒸气分液放出下层液体上层液体从上口倒出上层液体不可从下端放出容量瓶检查是否漏液洗涤容量瓶检查不漏液才可配制溶液清洗仪器洗液(或自来水)洗水(或蒸馏水)洗若有不溶物,先转化成可溶物侯氏制碱法通氨气至饱和通二氧化碳先通氨气再通二氧化碳,生成更多的NaHCO3配制稀硫酸把水加入烧杯中倒入浓硫酸不可把水加入到浓硫酸中排水法收集KMnO4制O2刚有气泡生成不收集连续气泡生成再收集绝不可先熄灭酒精灯再从水槽中移出导气管移出导管熄灭酒精灯配制氯化铁溶液溶解在较浓的盐酸中加水稀释不可直接溶解在水中MgCl2溶液制备无水MgCl2蒸发浓缩,降温结晶,得到MgCl2·6H2O在HCl气流中加热MgCl2·6H2O直接加热蒸干溶液得不到无水MgCl2试纸检验润湿检验pH试纸不可润湿检验SO42—加盐酸酸化加BaCl2溶液不可用硝酸酸化的氯化钡溶液知识点2常见物质的除杂物质所含杂质除杂质试剂主要操作方法(1)N2O2灼热的铜丝网用固体转化气体(2)COCO2NaOH溶液洗气(3)CuCuO稀盐酸或稀硫酸过滤(4)NH3H2O碱石灰通过碱石灰干燥管(5)Fe2O3Al2O3NaOH溶液过滤(6)Cl2HCl饱和食盐水洗气(7)乙烯SO2、H2O碱石灰加固体转化法(8)甲烷(乙烷)C2H4溴的四氯化碳溶液洗气(9)溴苯Br2NaOH稀溶分液(10)苯苯酚NaOH溶液分液(11)CO2HCl(SO2)饱和NaHCO3溶液洗气(12)NONO2水洗气(13)SO2HCl饱和NaHSO3溶液洗气(14)Na2CO3NaHCO3加热转化法(15)FeCl3溶液FeCl2Cl2加氧化剂转化法(16)FeCl2溶液FeCl3Fe加还原剂转化法(17)I2晶体NaCl加热升华(18)KNO3晶体NaCl蒸馏水重结晶(19)乙醇水(少量)新制CaO蒸馏(20)丁醇乙醚蒸馏知识点3.离子检验(1)常见阳离子的检验阳离子检验方法反应的离子方程式NH+4铵盐(或浓溶液)与NaOH溶液共热,放出使湿润的红色石蕊试纸变蓝的有刺激性气味的气体NH+4+OH-=====△NH3↑+H2ONa+、K+用焰色反应来检验时,它们的火焰分别是黄色、浅紫色(透过蓝色钴玻璃片观察)—Al3+能与适量的NaOH溶液反应生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液Al3++3OH-===Al(OH)3↓Al(OH)3+OH-===AlO-2+2H2OAl(OH)3+3H+===Al3++3H2OFe2+能与少量NaOH溶液反应,先生成白色沉淀,迅速变成灰绿色,最后变成红褐色;或向亚铁盐的溶液中加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色Fe2++2OH-===Fe(OH)2↓4Fe(OH)2+O2+2H2O===4Fe(OH)32Fe2++Cl2===2Fe3++2Cl-Fe3+能与KSCN溶液反应,变成红色溶液;能与NaOH溶液反应,生成红褐色沉淀Fe3++3SCN-===Fe(SCN)3Fe3++3OH-===Fe(OH)3↓Ag+能与稀盐酸或可溶性盐酸盐反应,生成白色沉淀,不溶于稀硝酸,但溶于氨水Ag++Cl-===AgCl↓AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O(2)常见阴离子的检验阴离子干扰离子排干扰措施Cl-SO2-4加过量的Ba(NO3)2溶液CO2-3加稀硝酸酸化OH-SO2-4CO2-3加盐酸酸化SO2-3Ag+SO2-3CO2-3加盐酸后将产生的气体通入品红溶液中CO2-3SO2-3加硝酸后将产生的无色无味气体通入澄清石灰水变浑浊知识点4.常见气体的检验(1)酸性气体的检验。(2)碱性气体的检验(NH3)。(3)还原性气体的检验。(4)强氧化性气体的检验。知识点5.常考实验装置分析装置装置的易错点或注意事项(1)不能在容量瓶中溶解溶质(2)玻璃棒要靠在刻度线以下,而不是刻度线以上(1)用玻璃棒引流(2)漏斗末端紧靠烧杯内壁(3)玻璃棒紧靠三层滤纸(1)分液漏斗末端紧靠烧杯内壁(2)分离的混合物符合萃取原理(3)分液漏斗的下层液体从下口流...