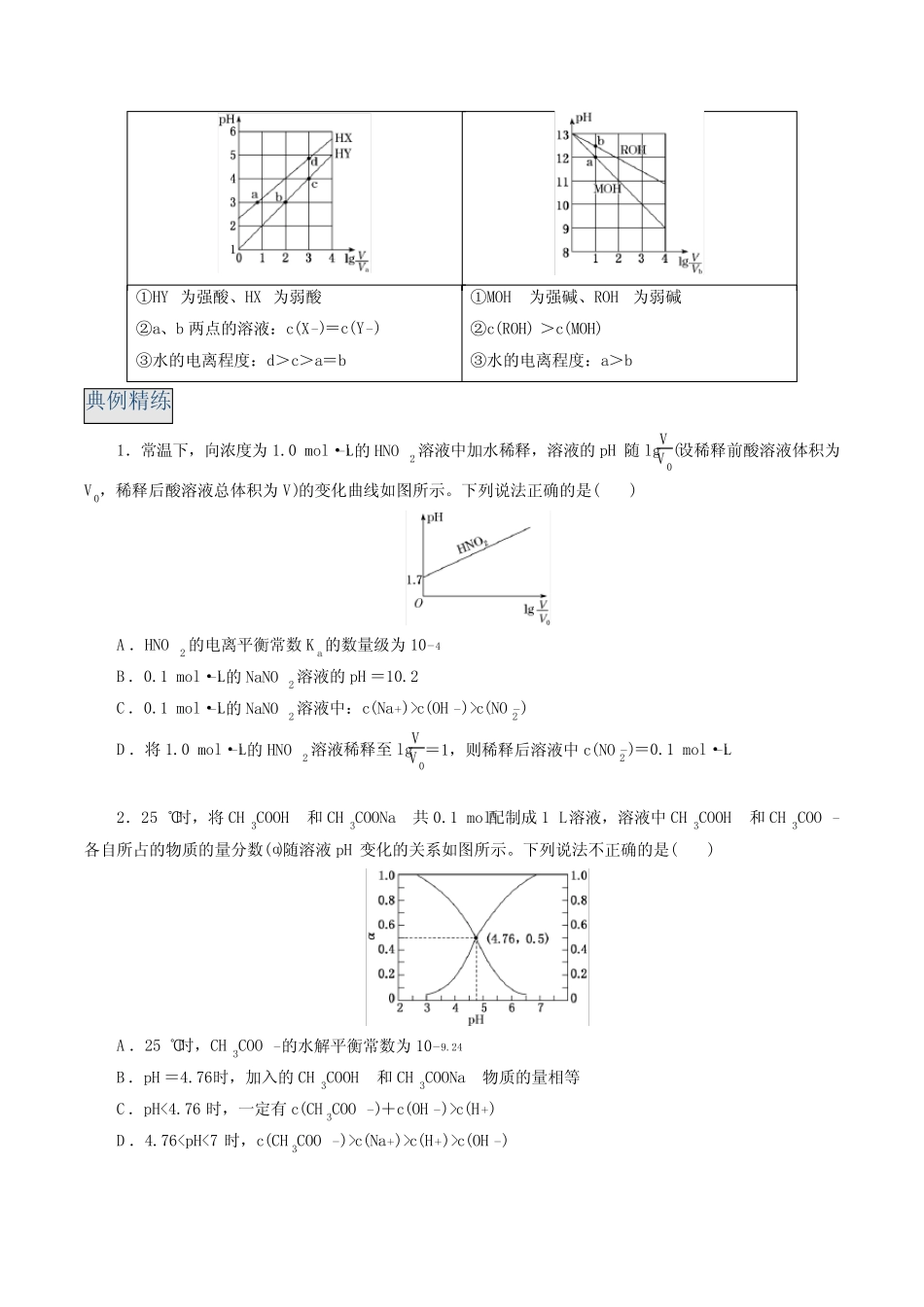
考点总览(1)考查水溶液的电离平衡和水解平衡。(2)结合滴定曲线考查离子平衡。(3)难溶电解质沉淀溶解平衡图像及分析。(4)结合盐类水解规律及三大守恒进行考查。考点精讲考点一、水溶液中的电离平衡与水解平衡1.把握电离常数、水解常数的关系和应用(1)影响两类常数的因素对于水溶液,只要温度不变,电离常数、水解常数就不变。(2)水解常数与电离常数、离子积之间的关系已知:常温下,弱酸H2A的电离常数为Ka1、Ka2,Na2A的水解常数分别为Kh1、Kh2,则:A2-的水解常数Kh1=KWKa2,HA-的水解常数Kh2=KWKa1。(3)利用电离常数和水解常数可判断溶液的酸碱性和离子浓度的大小如NaHA溶液,若HA-的水解常数(KWKa1)大于其电离常数(Ka2),则NaHA溶液显碱性,离子浓度的大小顺序为c(Na+)>c(HA-)>c(OH-)>c(H+)>c(A2-)。2.识别一强一弱溶液稀释的图像(1)相同体积、相同浓度的盐酸、醋酸加水稀释相同的倍数,醋酸的pH大加水稀释到相同的pH,盐酸加入的水多(2)相同体积、相同pH的盐酸、醋酸加水稀释相同的倍数,盐酸的pH大加水稀释到相同的pH,醋酸加入的水多(3)pH与稀释倍数的线性关系①HY为强酸、HX为弱酸②a、b两点的溶液:c(X-)=c(Y-)③水的电离程度:d>c>a=b①MOH为强碱、ROH为弱碱②c(ROH)>c(MOH)③水的电离程度:a>b典例精练1.常温下,向浓度为1.0mol·L-1的HNO2溶液中加水稀释,溶液的pH随lgVV0(设稀释前酸溶液体积为V0,稀释后酸溶液总体积为V)的变化曲线如图所示。下列说法正确的是()A.HNO2的电离平衡常数Ka的数量级为10-4B.0.1mol·L-1的NaNO2溶液的pH=10.2C.0.1mol·L-1的NaNO2溶液中:c(Na+)>c(OH-)>c(NO-2)D.将1.0mol·L-1的HNO2溶液稀释至lgVV0=1,则稀释后溶液中c(NO-2)=0.1mol·L-12.25℃时,将CH3COOH和CH3COONa共0.1mol配制成1L溶液,溶液中CH3COOH和CH3COO-各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是()A.25℃时,CH3COO-的水解平衡常数为10-9.24B.pH=4.76时,加入的CH3COOH和CH3COONa物质的量相等C.pH<4.76时,一定有c(CH3COO-)+c(OH-)>c(H+)D.4.76
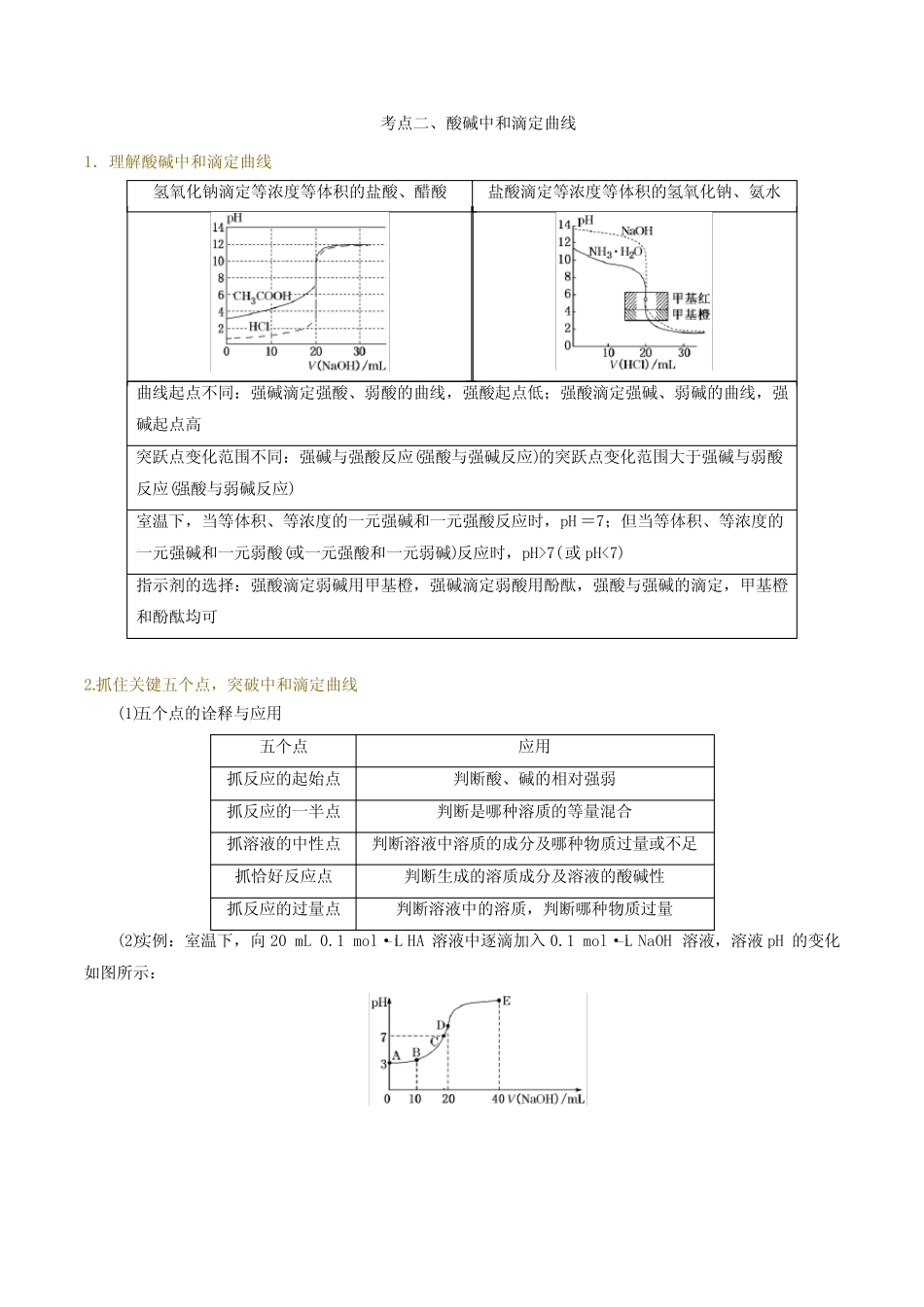
c(Na+)>c(H+)>c(OH-)考点二、酸碱中和滴定曲线1.理解酸碱中和滴定曲线氢氧化钠滴定等浓度等体积的盐酸、醋酸盐酸滴定等浓度等体积的氢氧化钠、氨水曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)室温下,当等体积、等浓度的一元强碱和一元强酸反应时,pH=7;但当等体积、等浓度的一元强碱和一元弱酸(或一元强酸和一元弱碱)反应时,pH>7(或pH<7)指示剂的选择:强酸滴定弱碱用甲基橙,强碱滴定弱酸用酚酞,强酸与强碱的滴定,甲基橙和酚酞均可2.抓住关键五个点,突破中和滴定曲线(1)五个点的诠释与应用五个点应用抓反应的起始点判断酸、碱的相对强弱抓反应的一半点判断是哪种溶质的等量混合抓溶液的中性点判断溶液中溶质的成分及哪种物质过量或不足抓恰好反应点判断生成的溶质成分及溶液的酸碱性抓反应的过量点判断溶液中的溶质,判断哪种物质过量(2)实例:室温下,向20mL0.1mol·L-1HA溶液中逐滴加入0.1mol·L-1NaOH溶液,溶液pH的变化如图所示:典例精练1.室温下,向20.00mL0.1000mol·L-1盐酸中滴加0.1000mol·L-1NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5。下列说法不正确的是()A.选择变色范围在pH突变范围内的指示剂,可减小实验误差B.用酸式滴定管量取20.00mL0.1000mol·L-1盐酸时,酸式滴定管水洗后需用待取液润洗C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定NaOH溶液的浓度,标定时采用甲基橙为指示剂D.V(NaOH)=10.00mL时,pH约为1.52.以0.10mol·L-1的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示滴定分数=滴定用量总滴定用量。下列表述错误的是()A.z点后存在某点,溶液中水的电离程度和y点的相同B.a约为3.5C.z点处,c(Na+)>c(A-)D.x点处的溶液中离子满...