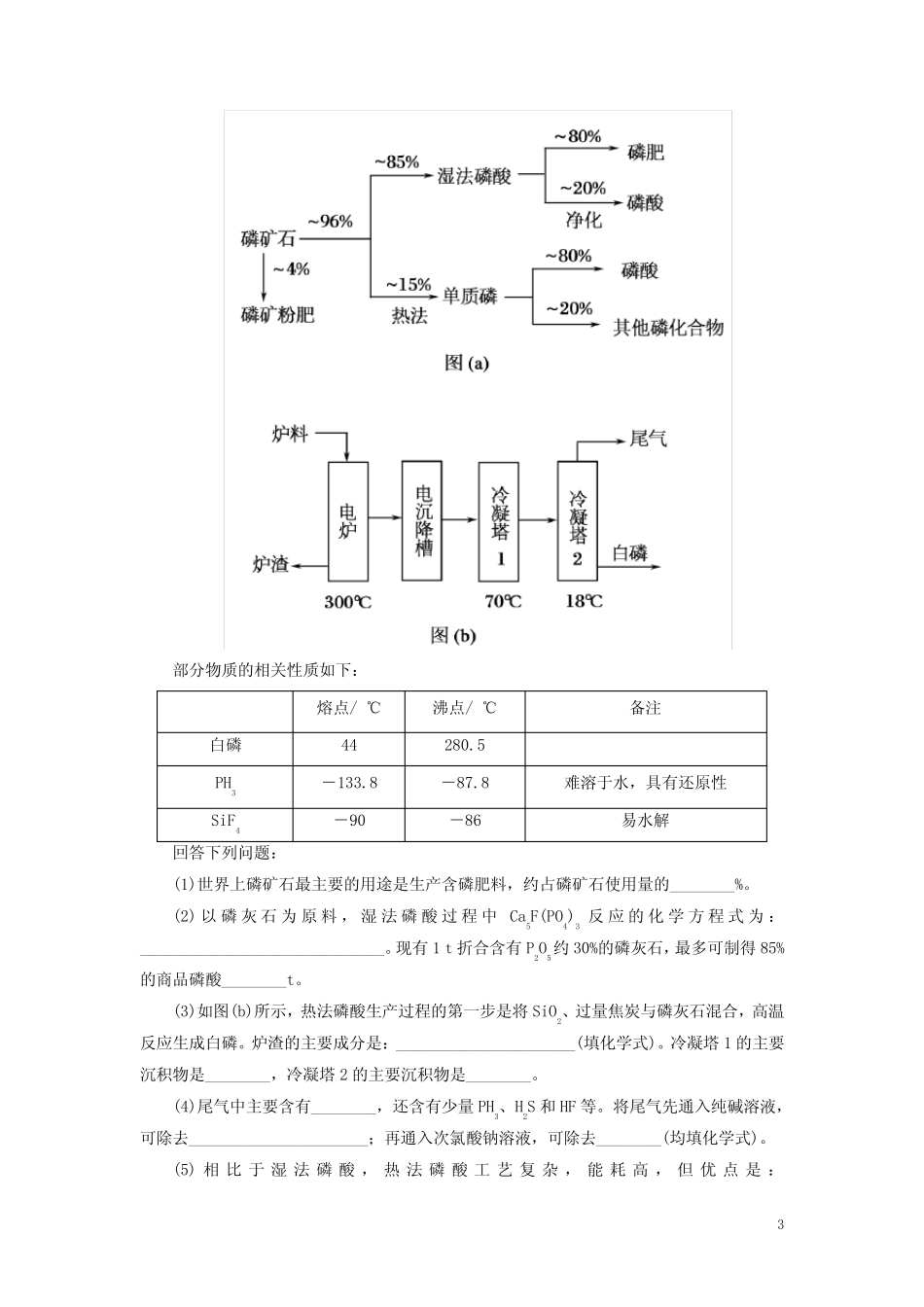
1第1步高考真题试水1.(2012·海南卷)污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是()A.氨水B.硫化氢气体C.硫酸钠溶液D.纯碱溶液解析:氨水、Na2SO4溶液均不能使Cu2+转化为沉淀,其中氨水与Cu2+形成配离子。答案:AC2.(2015·四川卷)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O===15FeSO4+8H2SO4,不考虑其它反应。请回答下列问题:(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是______________________________。(2)检验第Ⅱ步中Fe3+是否完全还原,应选择________(填字母编号)。A.KMnO4溶液B.K3[Fe(CN)6]溶液C.KSCN溶液(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽。通入空气引起溶液pH降低的原因是________。(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25℃,101kPa时:4Fe(s)+3O2(g)===2Fe2O3(s)ΔH=-1648kJ/molC(s)+O2(g)===CO2(g)ΔH=-393kJ/mol2Fe(s)+2C(s)+3O2(g)===2FeCO3(s)ΔH=-1480kJ/molFeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________________________________________。(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2===Fe+2Li2S。正极反应式是________。(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将akg质量分数为b%的硫酸加入到ckg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3________kg。解析:(1)Fe2O3溶解于稀H2SO4中,生成Fe2(SO4)3。(2)检验第Ⅱ步中Fe3+是否完全被还2原,即检验溶液中有无Fe3+,故可采用KSCN溶液,C项正确。(3)通入空气,部分Fe2+被氧化为Fe3+,后者水解程度比前者强,故通入空气溶液酸性增强。(4)由盖斯定律,将题中已知的第二个热化学方程式乘以4与第一个热化学方程式相加,再减去2倍的第三个热化学方程式,即得:4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)ΔH=-260kJ/mol。(5)正极发生还原反应,根据给出的总反应式可知正极的电极反应为FeS2+4e-===Fe+2S2-。(6)“浸取”反应为:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O;加入FeCO3时发生的反应为:FeCO3+H2SO4===FeSO4+CO2↑+H2O;还原过程生成硫酸:FeS2+7Fe2(SO4)3+8H2O===15FeSO4+8H2SO4。由题意知上述前四个反应消耗的硫酸之和与akg×b%及第3个反应生成的硫酸之和相等,据此可计算加入FeCO3的量,设加入FeCO3的质量为xkg,则akg×b%+[ckg×50%×96%/160kg·kmol-1]×2×814×98kg·kmol-1=ckg×50%×96%×3×98kg·kmol-1/160kg·kmol-1+xkg×98kg·kmol-1/116kg·kmol-1,解得x=29ab/2450-1131c/1750。答案:(1)Fe2O3+6H+===2Fe3++3H2O(2)C(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+(4)4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)ΔH=-260kJ/mol(5)FeS2+4Li++4e-===Fe+2Li2S或FeS2+4e-===Fe+2S2-(6)0.0118ab-0.646c或(29ab2450-1131c1750)3.(2014·新课标全国卷Ⅰ)磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程。3部分物质的相关性质如下:熔点/℃沸点/℃备注白磷44280.5PH3-133.8-87.8难溶于水,具有还原性SiF4-90-86易水解回答下列问题:(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的________%。(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:______________________________。现有1t折合含有P2O5约30%的磷灰石,最多可制得85%的商品磷酸________t。(3)如图(b)所示,热法...