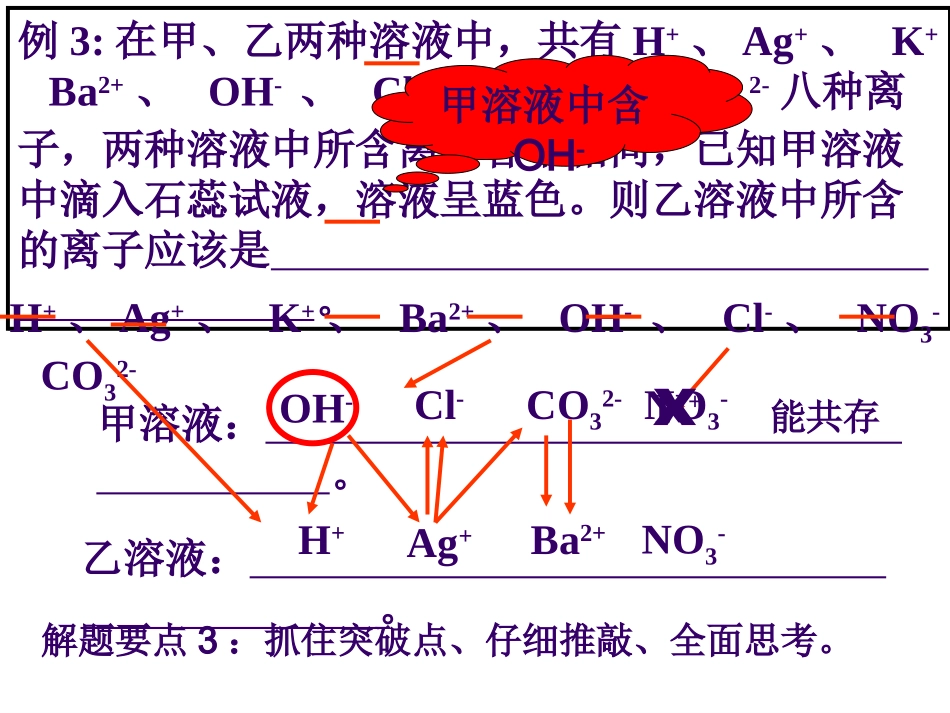
中考复习离子共存的判断例1:下列各组离子中,能够大量共存于同一溶液的是()A、CO32-、H+、Na+、NO3-B、H+、Ag+、Cl-、SO42-C、K+、NH4+、Cl-、OH-D、OH-、NO3-、K+、Na+D例2:在PH=1的无色溶液中,能够大量共存的一组是()A、Cl-、CO32-、Na+、OH-B、NO3-、Cu2+、Cl-、Fe3+、C、NO3-、SO42-、K+、Zn2+D、SO42-、NH4+、Ba2+、Cl-C解题要点1:相互反应的离子不能共存解题要点2:组内、组外不反应;且为无色。H+例题讲解例3:在甲、乙两种溶液中,共有H+、Ag+、K+、Ba2+、OH-、Cl-、NO3-、CO32-八种离子,两种溶液中所含离子各不相同,已知甲溶液中滴入石蕊试液,溶液呈蓝色。则乙溶液中所含的离子应该是。甲溶液中含OH-甲溶液:。乙溶液:。H+、Ag+、K+、Ba2+、OH-、Cl-、NO3-、CO32-OH-Ag+Cl-CO32-Ba2+H+NO3-ⅹNO3-K+解题要点3:抓住突破点、仔细推敲、全面思考。能共存1、在A、B、C、D四种物质的溶液中含有Na+、Fe3+、Ag+、Cu2+、SO42-、Cl-、OH-、NO3-等八种离子,现将这四种物质的稀溶液两两混合,有如下现象产生:⑴A+B→蓝色沉淀⑵D+C→白色沉淀(此沉淀不溶于稀硝酸)⑶B+D→红褐色沉淀根据上述现象,推断并写出各物质的化学式ABCD。ABCD。OHCuFeNaAgNO3Cl3SO4Cu(OH)2Fe(OH)3AgCl这种思维方法,你学会了吗?2.(重庆市中考试题)某不纯的碳酸钾样品中含有碳酸钠、硝酸钾和氯化钡三种杂质中的一种或几种,将13.8g样品溶于足量水中得到澄清溶液,再加入过量氯化钙溶液,得到9g沉淀。样品的组成可能是:(1)(2),(3)。(可以填满也可以不填满)K2CO3——CaCO3——Na2CO3138100106K2CO3、KNO3K2CO3、KNO3、Na2CO313.8g10g10.6g9g不纯不会单有中考例析:二、常见六种离子的鉴定方法:二、常见六种离子的鉴定方法:离子选择试剂实验现象结论H+OH-Cl-SO42-CO32-NH4+AgNO3和稀HNO3AgNO3和稀HNO3石蕊石蕊(铁、Na2CO3)(铁、Na2CO3)酚酞酚酞生成一种不溶于稀HNO3的白色沉淀生成一种不溶于稀HNO3的白色沉淀Ba(NO3)2和稀HNO3Ba(NO3)2和稀HNO3同上同上HCl和澄清石灰水HCl和澄清石灰水生成一种能使澄清石灰水变浑浊的气体生成一种能使澄清石灰水变浑浊的气体NaOH和红色石蕊试纸NaOH和红色石蕊试纸生成一种能使润湿红色石蕊试纸变蓝的气体生成一种能使润湿红色石蕊试纸变蓝的气体变红变红变红变红例1、某无色溶液中含有Cl-、SO42-、CO32-中的一种或几种怎样将它们逐一鉴别出来,写出操作步骤、现象、结论例1、某无色溶液中含有Cl-、SO42-、CO32-中的一种或几种怎样将它们逐一鉴别出来,写出操作步骤、现象、结论精讲精练实验步骤实验现象结论及化学方程式1、取样滴加足量稀HNO31、取样滴加足量稀HNO3产生气泡产生气泡有CO32-有CO32-若无现象若无现象无CO32-无CO32-2、滴加Ba(NO3)2试剂2、滴加Ba(NO3)2试剂产生沉淀产生沉淀有SO42-有SO42-若无现象若无现象无SO42-无SO42-3、滴加AgNO3试剂3、滴加AgNO3试剂产生沉淀产生沉淀有Cl-有Cl-若无现象若无现象无Cl-无Cl-•检验Cl-或SO42-时,为什么要加稀HNO3?检验Cl-和SO42—时,要加几滴稀硝酸,目的是除去CO32—等杂质离子的干扰。因为CO32—与AgNO3或BaCl2溶液接触时,也有白色沉淀Ag2CO3、BaCO3生成,但这些沉淀都溶于稀硝酸。如BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2OAg2CO3+2HNO3=2AgNO3+CO2↑+H2O而AgCl和BaSO4则不溶于稀硝酸,所以在检验时一定要加些稀硝酸,如果白色沉淀不溶解,才能确认有Cl-或SO42-。•溶液有可能同时存在Cl-和SO42-时,先检验哪种离子?应该先检验SO42-,而且用Ba(NO3)2溶液和稀硝酸代替BaCl2溶液和盐酸作试剂。且需将BaSO4沉淀滤去,再往滤液中加AgNO3溶液和稀硝酸检验Cl-。因为硫酸银微溶于水,如果溶液中SO42-浓度较大,若先检验Cl-,加入AgNO3溶液时,会生成Ag2SO4(微溶)沉淀,而干扰Cl-的检验。例3、硫酸铁溶液中溶质质量分数为10%,铁离子和水分子的数目之比是。例题讲解:解:设两种物质的分子个数分别为x、y:XFe2(SO4)3~yH2O400x:18y质量比10%M质:M剂=1:9故400x:18y=1:9x:y=1:200Fe3+:H2O=1:100练习:H2SO4(1);(2)。(NH4)2SO4(1);(2)。练习:H2SO4(1);(2)。(NH4)2SO4(1);(2)。三、物质的鉴定...