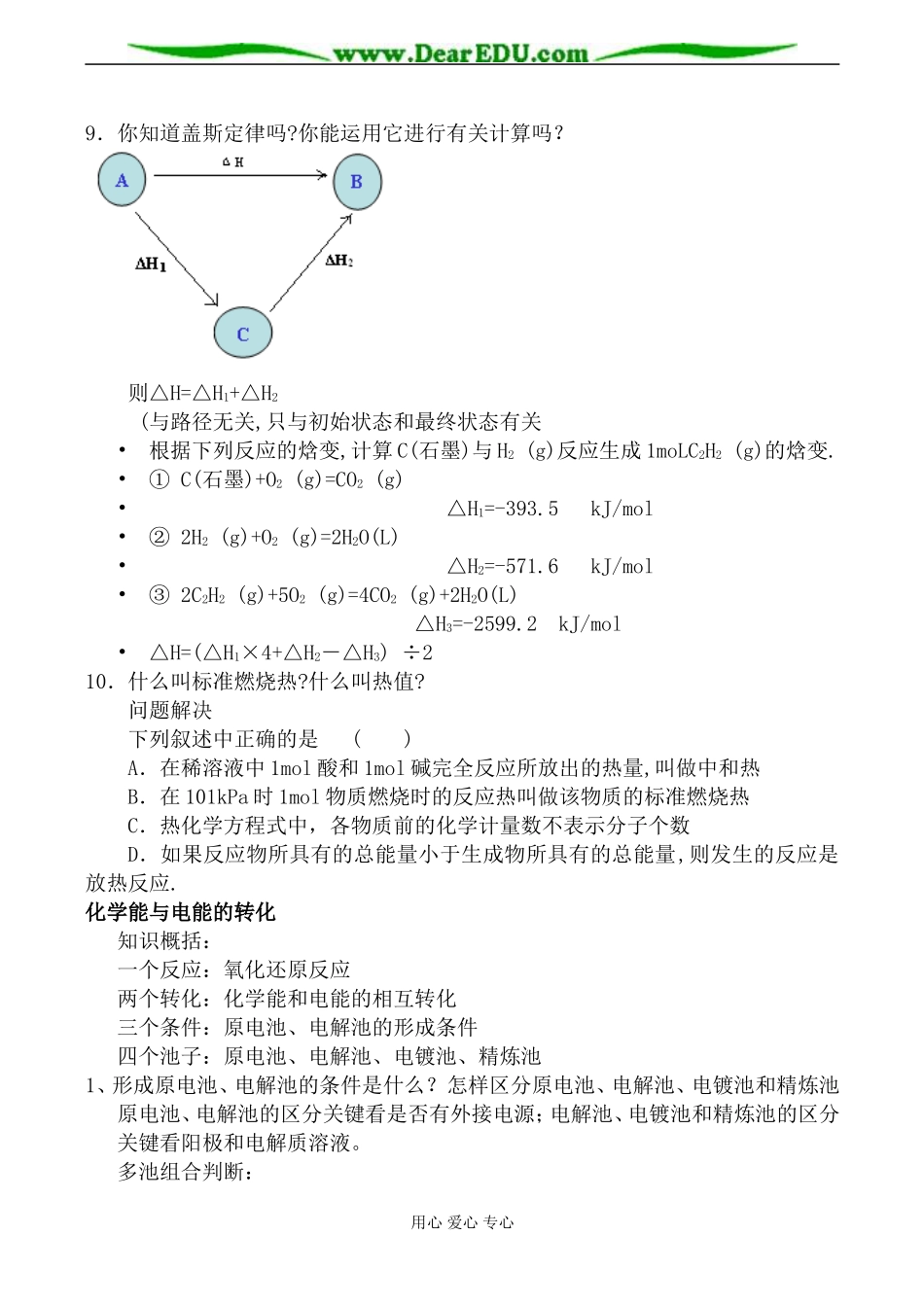
化学反应与能量变化教学目标:1.了解反应热和焓变的含义,正确书写热化学方程式。2.学会测量反应热的方法,理解盖撕定律的内容,运用并能够计算。3.理解原电池的形成条件、基本原理。了解日常生活中常用的化学电源和新型化学电池。掌握电解反应的基本原理和电解池的基本特征。4.了解什么是金属的腐蚀,金属腐蚀的本质是什么?教学重点和教学难点:正确书写热化学方程式,理解盖撕定律的内容,运用并能够计算,原电池和电解池基本原理。教学模式:自组总结与点拨结合化学反应中的热效应1、什么叫反应热?2、你知道“焓变吗”?与反应热有何关系?3、反应热与反应物和生成物具有的能量有何关系?问题解决下列说法错误的是()A.需要加热方能发生的反应一定是吸热反应B.放热的反应在常温下一定很容易发生C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小D.吸热反应在一定的条件下也能发生4、什么是放热反应和吸热反应?5、你知道“热化学方程式”吗?如何书写?问题解决已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是()A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2bkJ·mol-1B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=+2bkJ·mol-1C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4bkJ·mol-1D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=+bkJ·mol-16、什么是键能?7、你知道反应中的“焓变”与键能有什么关系?问题解决化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键用心爱心专心时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198;P—O:360;O=O:498;则反应P4(白磷)+3O2=P4O6的反应热ΔH为()A.-1638kJ·mol-1B.+1638kJ·mol-1C.-126kJ·mol-1D.+126kJ·mol-18.什么叫中和热?你能测定化学反应中放出的热量吗?注意事项(1).为确保50ml0.50mol∕L的HCl完全被NaOH溶液中和,常选用0.55mol∕LNaOH溶液,使碱稍稍过量.(2).大小烧杯口应持平,以减少热量的散失.(3).用0.1分刻度的温度计,温度计的水银球要完全悬浸在溶液中,等稳定一段时间后读数为准,要估读.(4).动作要快,以尽量减少热量的损失.50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量计算中和热。回答下列问题:(1)从实验装置上看,图中还缺少的一种玻璃仪器是。(2)烧杯间填满碎纸条的作是。(3)若大烧杯上不盖硬纸板,求得的中和热数值(填“偏大”“偏小”或“无影响”)。(4)实验中该用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由.(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会;用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热数值会(填“偏大”“偏小”或“无影响”)。用心爱心专心9.你知道盖斯定律吗?你能运用它进行有关计算吗?则△H=△H1+△H2(与路径无关,只与初始状态和最终状态有关•根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1moLC2H2(g)的焓变.•①C(石墨)+O2(g)=CO2(g)•△H1=-393.5kJ/mol•②2H2(g)+O2(g)=2H2O(L)•△H2=-571.6kJ/mol•③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(L)△H3=-2599.2kJ/mol•△H=(△H1×4+△H2-△H3)÷210.什么叫标准燃烧热?什么叫热值?问题解决下列叙述中正确的是()A.在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热B.在101kPa时1mol物质燃烧时的反应热叫做该物质的标准燃烧热C.热化学方程式中,各物质前的化学计量数不表示分子个数D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应.化学能与电能的转化知识概括:一个反应:氧化还原反应两个转化:化学能和电能的相互转化三个条件:原电池、电解池的形成条件四个池子:原电池、电解池、电镀池、精炼池1、形成原电池、电解池的条件是什么?怎样区分原电池、电解池...