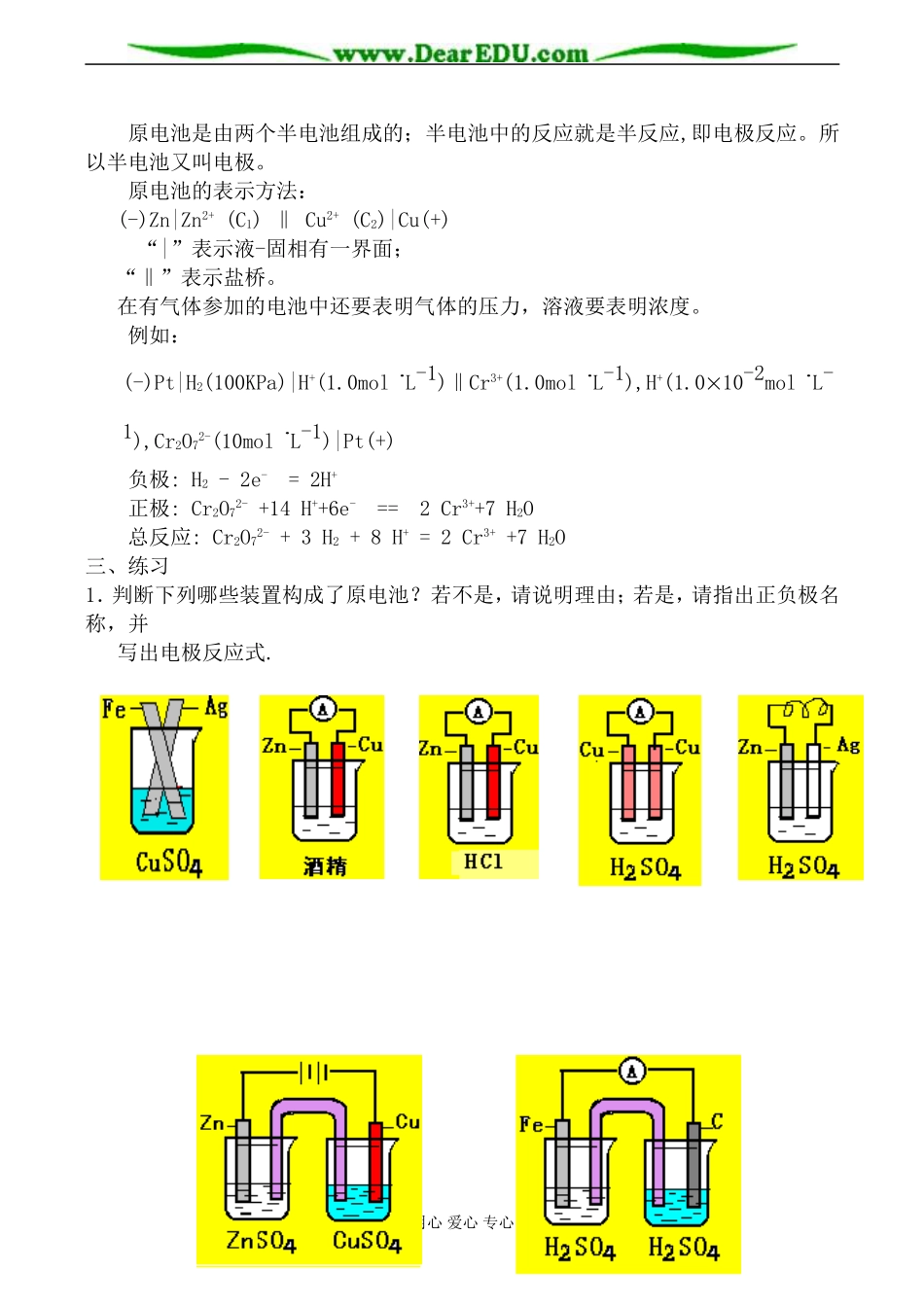
原电池的工作原理教学目的:理解原电池的形成条件、基本原理。教学重点:原电池的基本原理教学过程:一、自学探究1.探究[实验1]的现象和结论2.探究[实验2]的现象和结论3.原电池工作原理4.构成原电池的条件5.原电池正负极的判断方法及电极反应、电池反应的书写二、总结1.[实验1]的现象:锌粉溶解,有红色物质析出,温度计显示温度迅速上升.结论:Zn+Cu2+=Zn2++Cu化学能热能2.[实验2]的现象:锌片变细,铜上有红色物质析出,电流计指针发生偏转.结论:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu化学能电能3.原电池工作原理较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电路流向较不活泼的金属(正极)。4.构成条件:有自发的氧化还原反应发生(1)两个活性不同的电极(2)有电解质溶液(3)能形成闭合回路5.盐桥:在U型管中装满用饱和KCl溶液和琼胶作成的冻胶。盐桥的作用:使Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极。这种装置能将化学能转变为电能,称为原电池(PrimaryCell)6.原电池正负极的判断方法及电极反应、电池反应的书写正极(铜电极):Cu2++2e-=Cu负极(锌电极):Zn-2e-=Zn2+电池反应:Zn+Cu2+=Zn2++Cu(总反应)知识拓展:用心爱心专心原电池是由两个半电池组成的;半电池中的反应就是半反应,即电极反应。所以半电池又叫电极。原电池的表示方法:(-)Zn|Zn2+(C1)‖Cu2+(C2)|Cu(+)“|”表示液-固相有一界面;“‖”表示盐桥。在有气体参加的电池中还要表明气体的压力,溶液要表明浓度。例如:(-)Pt|H2(100KPa)|H+(1.0molL-1)‖Cr3+(1.0molL-1),H+(1.0´10-2molL-1),Cr2O72-(10molL-1)|Pt(+)负极:H2-2e-=2H+正极:Cr2O72-+14H++6e-==2Cr3++7H2O总反应:Cr2O72-+3H2+8H+=2Cr3++7H2O三、练习1.判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.用心爱心专心2.试将下列两个氧化还原反应分别设计成两个原电池Zn+2AgNO3=Zn(NO3)2+2Ag2Fe3++Fe=3Fe2+3.依探究实验2的原理,按:Cu+2AgNO3====Cu(NO3)2+2Ag的反应设计一个能持续产生电流的原电池装置,画出装置图。4.为获得较长时间的稳定电流,如何将必修2中由“Zn-稀H3SO4-Cu”组成的原电池(如左下图)进行简单改装?四、小结(一).原电池:把化学能直接转化为电能的装置。(二).构成原电池的基本条件:1.有两块金属(或非金属)导体作电极;2.两个电极相连插入电解质溶液中并形成闭合电路;3.有可自发发生的氧化还原反应。(三).加入盐桥后由两个半电池组成的原电池工作原理:1.用还原性较强的物质(如:活泼金属)作负极,向外电路提供电子;用氧化性较强的物质作正极,并在正极得到电子;2.原电池在放电时,负极上的电子经过导线流向正极,而氧化性较强的物质从正极上得到电子,两极之间再通过盐桥及池内溶液中的阴、阳离子定向运动形成的内电路构成有稳定电流的闭合回路。用心爱心专心