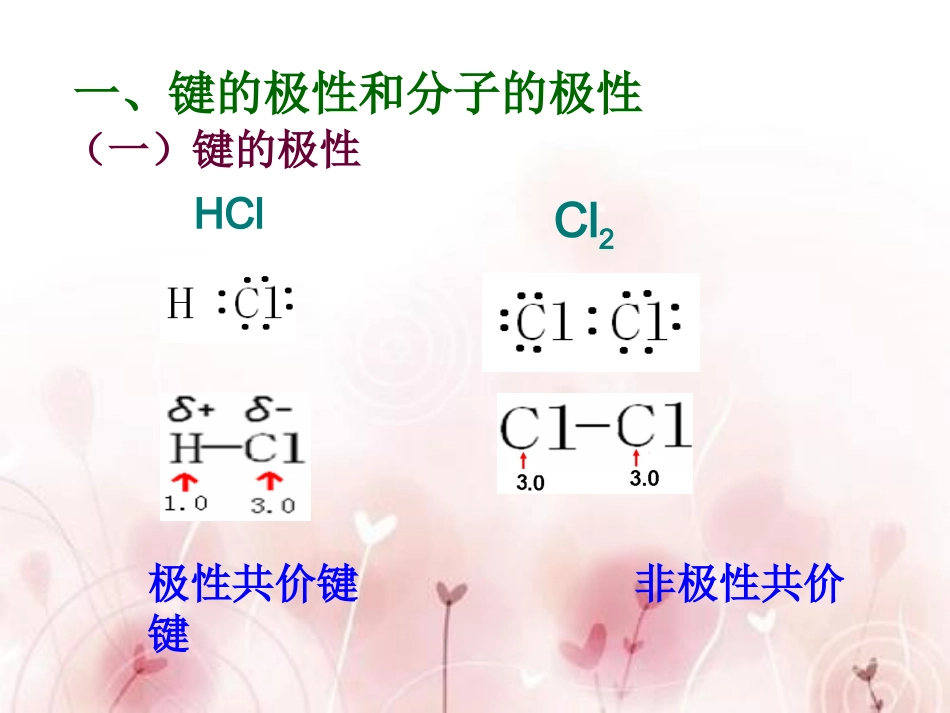
第二章分子结构与性质第三节分子的性质极性共价键非极性共价键一、键的极性和分子的极性(一)键的极性HClCl22、判断方法:(1)同种非金属元素的原子间形成的共价键是非极性键。(2)不同种非金属元素的原子间形成的共价键是极性键。根据电荷分布是否均匀,共价键有极性、非极性之分,以共价键结合的分子是否也有极性、非极性之分呢?分子的极性又是根据什么来判定呢?思考:极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合看正电中心和负电中心是否重合化学键的极性的向量和是否等于零2、判断方法:1、概念(二)分子的极性共用电子对Cl2分子中,共用电子对不偏向,Cl原子都不显电性,为非极性分子∴以非极性键结合的分子均为非极性分子ClClClClHCl共用电子对HClHCl分子中,共用电子对偏向Cl原子,∴Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀,∴为极性分子δ+δ-∴以极性键结合的双原子分子为极性分子在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)从力学的角度分析:分子中各键的极性向量和C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消(F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子180ºF1F2F合=0OOCHOHF1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是折线型构型,两个O-H键的极性不能抵消(F合≠0),∴整个分子电荷分布不均匀,是极性分子HHHNBF3NH3120º107º18'三角锥型,不对称,键的极性不能抵消,是极性分子F1F2F3F’平面三角形,对称,键的极性互相抵消(F合=0),是非极性分子109º28'正四面体型,对称结构,C-H键的极性互相抵消(F合=0),是非极性分子CHHHHF合1.由非极性键构成的分子一定是非极性分子。2.由极性键构成的双原子分子一定是极性分子。3.在含有极性键的多原子分子中,如果结构对称则键的极性得到抵消,其分子为非极性分子。如果分子结构不对称,则键的极性不能完全抵消,其分子为极性分子。经验规律:在ABn型分子中,当A的化合价数值等于其最外层电子数时,该分子为非极性分子.分子极性的判断注意:由同种元素组成的非金属单质分子不一定是非性分子。(比如O3)第二章分子结构与性质第三节分子的性质分子间作用力和氢键思考:冰熔化、水气化现象是什么变化?化学键破坏了吗?为什么要吸收热量?OOHHHHOOHHHH化学键化学键((强烈强烈))分子间分子间作用力作用力((较弱较弱))OOHHHHOOHHHH汽化破坏分子间作用力OOHHHHOOHHHH化学键化学键((强烈强烈))2O2O4H4HOO22HH22破坏化学键电解一、分子间作用力(1)存在:分子之间1.概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力。(2)强弱:比化学键弱OOHHHHOOHHHH分子间作用力分子间作用力((较弱较弱))化学键化学键((强烈强烈))作用微粒作用力强弱大小范围化学键分子间作用力(范德华力)原子或离子之间分子之间微弱作用分子间作用力与化学键的比较强烈作用125--836KJ/mol2--20KJ/mol干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么?思考:F2Cl2Br2I2F2Cl2Br2I2沸点熔点相对分子质量0-50-100-150-200-2505010015020025050100150200250温度/℃第VIIA单质的熔、沸点与相对分子质量的关系0-50-100-150-200-25050100150200250100300200400温度/℃相对分子质量×××500××××CF4CCl4CBr4CF4CCl4CBr4CI4沸点熔点四卤化碳的熔沸点与相对分子质量的关系分子间的作用力强弱(范德华力)组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。一、分子间作用力(1)存在:分子之间1.概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。(2)强弱:比化学键弱(3)主要影响物质的物理性质(熔沸点和溶解度)组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。2.请预测的熔沸点高低(1)HF、HCl、HBr、HI(2)H2O、H2S、H2Se、H2Te(3)NH3、PH3、AsH3、SbH3...