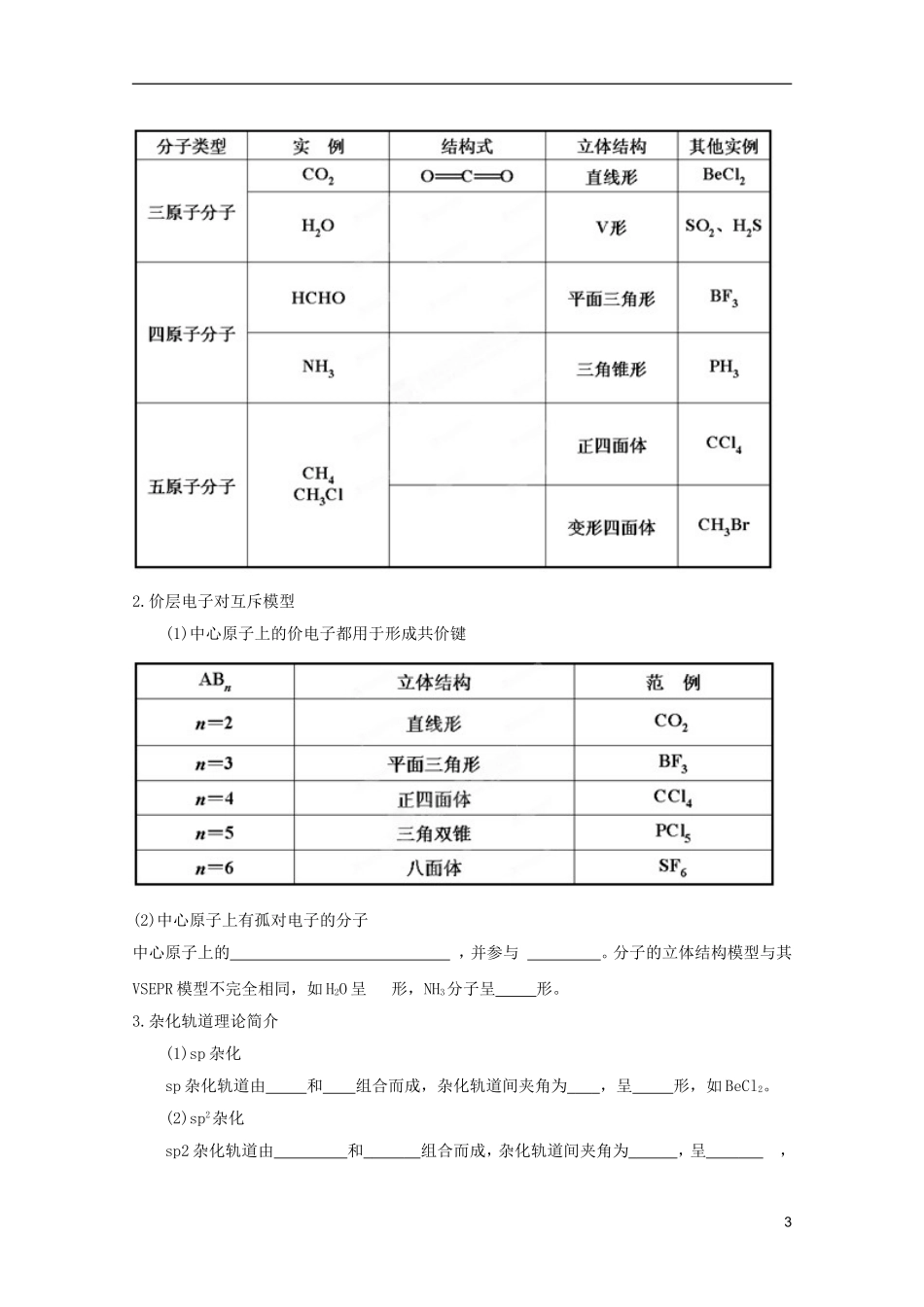
2013化学复习知识点深度剖析教案:专题十一第二章化学键与分子间作用力(人教版)考纲解读1.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。III1.σ键和π键的特征和性质.2.常见分子的立体结构、中心原子杂化类型的判断.3.分子极性的判断以及大小比较.4.分子间作用力、氢键、配位键的特点及其对物质性质的影响.2.了解共价键的主要类型σ键和π键,能用键能、键长、键角等说明简单分子的某些性质。I3.了解简单配合物的成键情况。I4.理解金属键的含义,能用金属键理论解释金属的一些物理性质。III5.了解杂化轨道理论及常见的杂化轨道类型(sp,sp2,sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间结构。II6.了解化学键和分子间作用力的区别。I7.了解氢键的存在对物质性质的影响,能列举含有氢键的物质。I基础巩固一、共价键1.共价键(1)本质在原子之间形成。(2)基本特征①性。②性。12.共价键的类型(1)σ键①分类②形成:原子轨道以“头碰头”方式重叠而成。a.ssσ键:由两个重叠形成,如H—H。b.spσ键:由一个和一个重叠形成,如H—Cl。c.ppσ键:由重叠形成,如Cl—Cl。③特征σ键的电子云具有性。(2)π键①形成:两个原子的p电子“”重叠形成。②特征:π键的电子云具有性。3.键参数(1)键能原子形成化学键释放的最低能量。键能越,化学键越稳定。(2)键长形成共价键的两个原子之间的。键长越,共价键越稳定。(3)键角在原子数超过2的分子中,两个共价键之间的夹角。如O===C===O键角为;H—O—H键角为。二、分子的立体结构1.常见分子的立体结构22.价层电子对互斥模型(1)中心原子上的价电子都用于形成共价键(2)中心原子上有孤对电子的分子中心原子上的,并参与。分子的立体结构模型与其VSEPR模型不完全相同,如H2O呈形,NH3分子呈形。3.杂化轨道理论简介(1)sp杂化sp杂化轨道由和组合而成,杂化轨道间夹角为,呈形,如BeCl2。(2)sp2杂化sp2杂化轨道由和组合而成,杂化轨道间夹角为,呈,3如。(3)sp3杂化sp3杂化轨道由和组合而成,杂化轨道间夹角为,呈形,如。三、分子的性质1.键的极性和分子极性(1)极性键和非极性键①极性键:电子对的共价键。②非极性键:的共价键。(2)极性分子和非极性分子①极性分子:正电中心和负电中心不重合的分子。②非极性分子:正电中心和负电中心重合的分子。2.范德华力及其对物质性质的影响(1)概念与之间存在着的一种把分子聚集在一起的作用力。(2)特点范德华力,约比化学键能小1~2数量级。(3)影响因素①越大,则范德华力越大。②越大,则范德华力越大。(4)对物质性质的影响范德华力主要影响物质的性质,化学键主要影响物质的性质。3.氢键及其对物质性质的影响(1)概念氢键是一种,它是由已经与电负性很强的原子形成共价键的氢原子与的原子之间的作用力。其表示方法为。(2)特点①大小:介于和之间,约为化学键的分之几,不属于化学键。②存在:氢键不仅存在于,有时也存在于。③氢键也和共价键一样具有性和性。(3)对物质性质的影响主要表现为使物质的熔、沸点,对物质的电离程度和溶解性等物理性质产生影响。44.溶解性(1)“相似相溶”的规律:非极性溶质一般能溶于,极性溶质一般能溶于。如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性。(2)“相似相溶”还适用于分子结构的相似性。如乙醇与水互溶,而戊醇在水中的溶解度明显。(3)如果溶质与水发生反应,将增加物质的溶解度,如等。四、离子键、配位键与金属键(一)离子键1.概念阴、阳离子通过____________形成的化学键。2.形成过程3.判断成键原子所属元素的电负性差值______,越容易形成离子键,一般认为当成键原子所属元素的电负性差值_________时,原子间才有可能形成离子键。4.实质离子键的实质是___静电作用________,它包括阴、阳离子之间的___________和两原子核及它们的电子之间的______两个方面。其中,静电引力用公式__________表示。5.特征离子键没有_______性和_______性。(二)配位键1.配位键(1)概念:成键的两个原子一方提供__________,一方提供________而形成的化学键。5(2)形成条件及表示方法一方有提供...