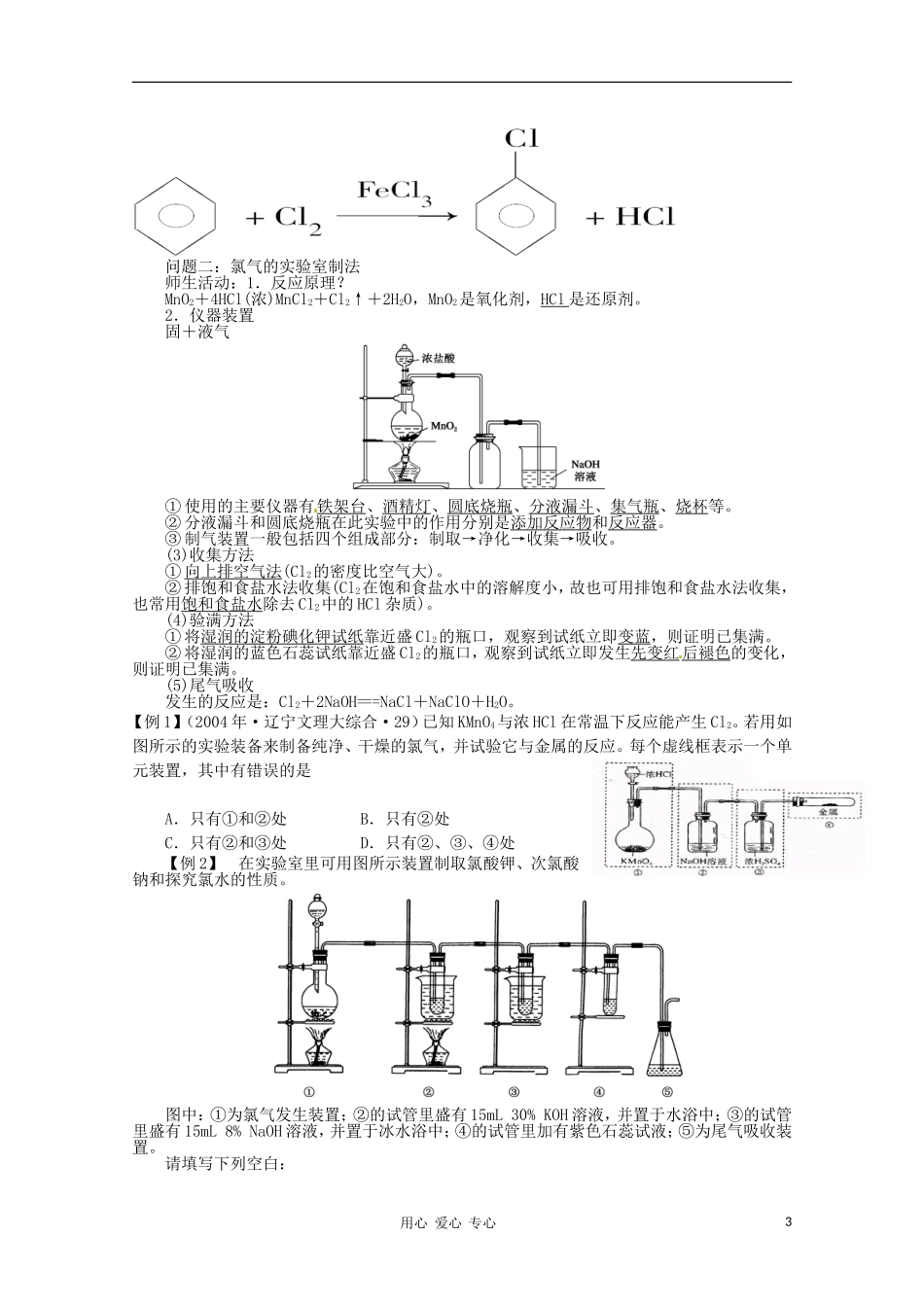
第11讲:氯及其化合物【内容与解析】本节课复习的内容是氯及其化合物的性质与应用。主要是通过氯气与单质的反应,氯气与水的反应氯气与碱的反应,但在其反应过程中应该记住反应的现象。第二个问题就是关于氯气的制法上,它是一个气体的制备实验,是高考过程中的主要实验考查的方向,所以本节课是复习的重要内容。应该重要的地方放在两个地方,这样就能加强这两个方面的训练。【教学目标与解析】1.教学目标1.了解氯元素单质及其重要化合物的主要性质及应用。2.了解氯元素单质及其重要化合物对环境质量的影响。2.目标解析1.了解氯元素单质及其重要化合物的主要性质及应用。就是指氯与单质的反应,氯与水的反应,氯与碱的反应,其应用主要是体现在氯与碱的反应中作为漂白液与漂白粉的制取。2.了解氯元素单质及其重要化合物对环境质量的影响。就是指氯气是有毒的,所以在其收集以及其作为物质的生成来说一定要进行尾气的吸收。【问题诊断分析】本节中学生感到困难的地方就是在于复习过程中,关于氯的计算上,特别是在氯气的制备这个实验问题上的计算,因为这个过程中关于氯气的计算中氯化氢一定要过量,因为这个物质在反应中是浓溶液。所以在这个问题上要与学生分析清楚。【教学条件支持】这节课主要是通过PPT这个手段,因为这样能加快复习的速度,节约复习的时间。【复习过程】问题一:氯的结构与性质设计意图:结构决定性质。学习物质的性质,首先要清楚他的结构。师生活动:1.氯的原子结构?氯元素位于第三周期第ⅦA族,其原子结构示意图为,氯原子最外层有7个电子易得到1个电子而形成氯离子,是活泼的非金属元素。在自然界中以化合态形式存在。2.氯气的物理性质?通常情况下,氯气是黄绿色,有刺激性气味的气体,密度比空气大,易溶于水,有毒,易液化。特别提醒:气体的颜色通常是解无机推断题的题眼。3.氯气的化学性质?(1)与金属反应2Na+Cl2======2NaCl(现象:黄色火焰,白烟)Cu+Cl2======CuCl22Fe+3Cl2=====2FeCl3(2)与非金属反应H2+Cl22HCl(现象:安静燃烧,苍白色火焰)HCl溶于水形成盐酸,工业上利用此方法生产盐酸。例1::(07年上海)有关物质燃烧时火焰颜色描述错误的是A氢气在氯气中燃烧-苍白色B钠在空气中燃烧——黄色C乙醇在空气中燃烧——淡蓝色D硫在氧气中燃烧——绿色(3)与水反应化学方程式为:Cl2+H2O===HCl+HClO,离子方程式为:Cl2+H2O===H++Cl-+HClO(Cl2既是氧化剂又是还原剂)。①氯气的水溶液叫氯水,饱和氯水呈浅黄绿色,主要含有H2O、Cl2、HClO、H+、Cl-、ClO-等粒子。②次氯酸的性质a.弱酸性:是一元弱酸,属弱电解质,酸性弱于碳酸。b.不稳定性:2HClO2HCl+O2↑(氯水要现用现制,保存在棕色试剂瓶中)。c.强氧化性:HClO能氧化许多物质。d.杀菌漂白性:能使有色布条、品红等有色物质褪色,其原理主要是利用其强氧化性。(4)与碱液反应①与碱的反应Cl2+2NaOH===NaCl+NaClO+H2O(工业制漂白液,实验室吸收多余的Cl2)。用心爱心专心12Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O(工业生产漂粉精)。②漂白粉a.漂白粉(有效氯含量为35%)的有效成分是Ca(ClO)2,漂粉精(有效氯含量为70%)的主要成分是Ca(ClO)2。b.NaClO、Ca(ClO)2都比HClO要稳定,容易保存。c.漂白原理:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO,2NaClO+CO2+H2O===Na2CO3+2HClO。d.漂白液、漂白粉和漂粉精既可用于漂白又可用于消毒,露置于空气中会与CO2反应而变质,所以需要隔绝空气密封保存。:例题1:(2003年广东、22、12分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。(1)单质L是(2)化合物B是(3)图中除反应①以外,还有两个用于工业生产的反应,是和(填代号)。它们的化学反应方程式分别是(5)与还原性物质反应Cl2+2FeCl2===2FeCl3(溶液从浅绿色变为棕黄色)。Cl2+2KI===2KCl+I2(用湿润的KI淀粉试纸检验Cl2的存在)。例题:(09年海南化学·13)(9分)有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。请回答...