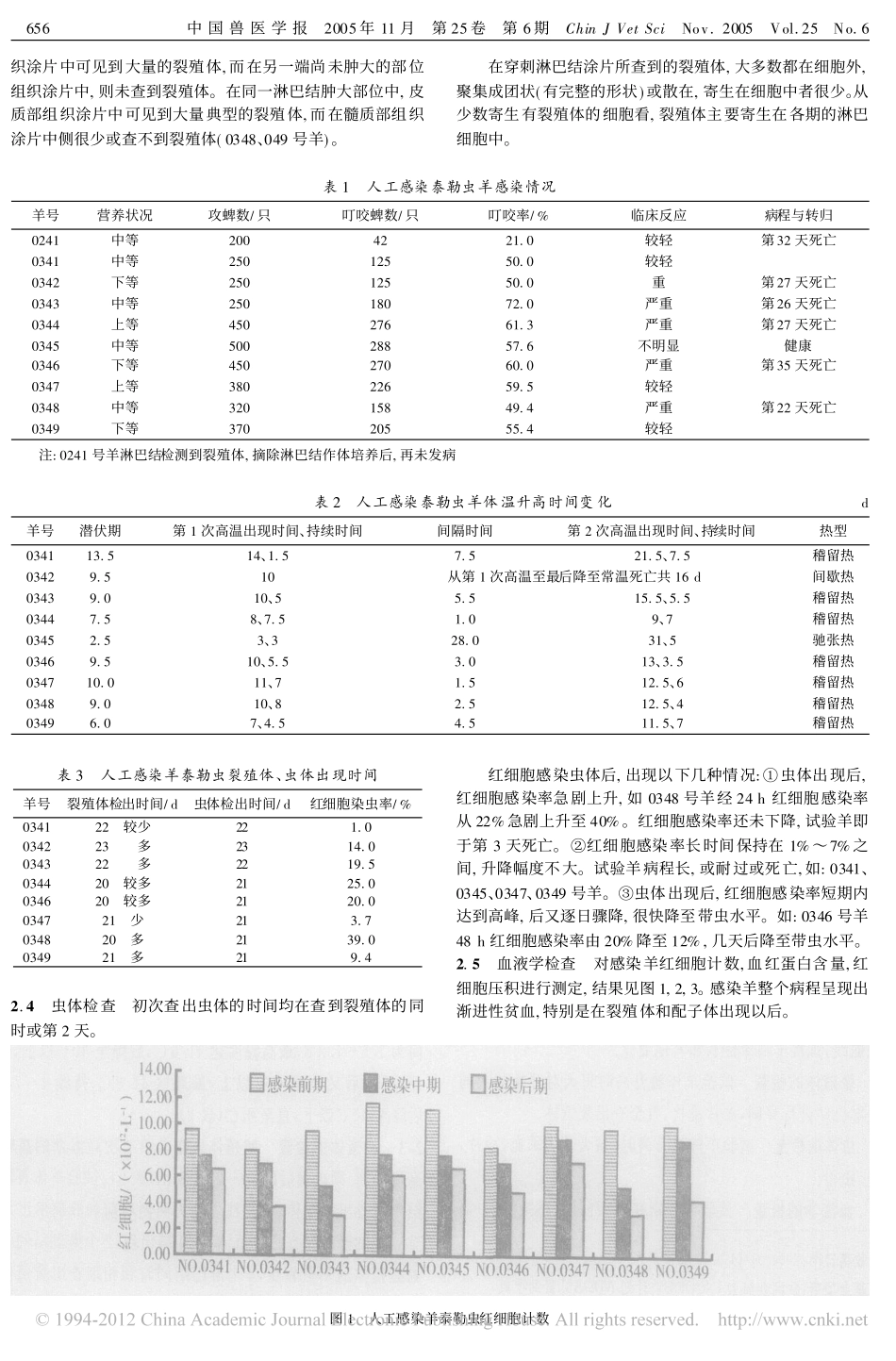
人工感染泰勒虫羊临床症状、血液学以及抗体水平的变化袁建丰1,2,吴鉴三2*,于建敏2,王志亮2,宋翠平2,姚宝安1(1.华中农业大学动物医学院,湖北武汉430070;2.农业部动物检疫所,山东青岛266032)摘要:用从甘肃采集的甘肃血蜱人工感染试验羊,观察其临床症状、血液学及抗体水平的变化。在试验中,试验羊表现出2个高温峰,裂殖体在第2个高温期出现。血液学观察表明,裂殖体产生阶段对试验羊造成的危害最大。通过对试验羊临床症状、血液学及抗体水平变化的统计学分析,表明3者之间存在一定的关联。关键词:羊泰勒虫;临床症状;血液学;抗体水平中图分类号:S855.9文献标识码:A文章编号:1005-4545(2005)06-0655-04收稿日期:2004-04-14基金项目:欧洲委员会INCODEV计划ADDAV资助项目(ICA4-CT-2000-30028)作者简介:袁建丰(1978-),男,硕士。*通讯作者我国羊泰勒虫最近被鉴定为对锦羊和山羊具有高度致病性的小反刍兽泰勒虫新种[1]。羊泰勒虫病主要通过甘肃血蜱传播[1-3],每年的3月末至6月为主要的流行时期,4、5月为高峰期[4]。在我国,主要分布于甘肃、新疆、内蒙古、青海、四川和陕西等西北地区[5]。我国的羊泰勒虫病最早报道于20世纪50年代末,当时归类为绵羊泰勒虫(Theileriaovis),80年代又把它归类为山羊泰勒虫(Theileriahirci)[6],直到2000年Schnittager等[7]通过对核糖体亚单位RNA基因序列的分析,确定其为不同于山羊泰勒虫(Theilerialestoquardi)和环形泰勒虫(Theileriaannulata)的一个新种,被称为Theileriasp.(China)。羊泰勒虫作为一个新鉴定的种,其许多方面对它了解的还很少。我们用从甘肃采集的饥饿(未曾吸血)雌性成蜱人工感染试验羊,通过对观察试验羊临床、体温、血液学以及抗体水平的变化,来探讨它们之间可能存在的关系。1材料与方法1.1试验动物4~6月龄小尾寒羊10只,血液学检查无血液原虫感染,购自胶东农村。1.2感染用蜱采自甘肃省麦河县麻当乡羊泰勒虫流行地区,从草原上抓获的饥饿(未曾吸血)雌性成蜱或从羊体上抓获的饥饿稚蜱。1.3血清羊泰勒虫阴性血清采自健康、泰勒虫阴性羊。1.4主要试剂荧光结合物,购自Sigma公司,-20℃保存;肝素钠,4℃保存;冷丙酮,4℃保存。1.5蜱感染在试验羊的左、右腹部及胸部分2~3个点粘上布袋,每只山羊局部集中放入蜱200~500只,试验羊单独保定饲养。1.6体温观察每天测体温2次(上、下午各1次),记录并绘成曲线,观察羊临床症状和其他变化。1.7裂殖体的检查试验羊体温升高时每天对开始肿大的体表淋巴结进行穿刺,涂片镜检,直至查出裂殖体。1.8虫体的检查试验羊体温升高时,每天耳尖采血,涂片,染色,镜检。1.9血液学的检查试验羊分别在感染前期、感染中期(高温期)、感染后期(虫体出现后),耳尖采血,分别用细胞计数板、血红蛋白仪、微量血液压积离心机(CLENENTSMicroHaematocrit)对红细胞、血红蛋白含量以及红细胞压积进行检查统计。1.10IFA抗原片的制备当寄生虫血症达到高峰时,静脉采血100mL(加肝素);于2LPBS慢慢混合;4℃500×g10min,去掉上清;将底层红细胞再次悬浮于2LPBS中,重复上述离心,洗涤4次,最后一次加双倍PBS(含5%牛血清白蛋白)稀释红细胞,按每孔5LL红细胞悬液滴加于玻片上,风干。-70℃保存备用。1.11间接荧光抗体试验(IFA)抗原片用冷丙酮(4℃)固定10min,自然干燥;每孔加血清10LL;玻片放在湿盒中37℃,40min;用PBS冲洗掉血清,再依次浸泡在PBS、去离子水、PBS中10min;该玻片依次加稀释的荧光抗体结合物10LL(棋盘加样,测定工作浓度);该玻片放在湿盒中37℃,40min;用PBS冲洗掉结合物,再在PBS中洗涤3次,每次5min;将盖玻片上加100LLPBS甘油封片,荧光镜检。2结果2.1蜱感染情况每只羊放入蜱200~500只,实际叮咬蜱数为42~288只(表1),试验羊发病9只,发病率为90%,均表现出明显的临床症状和体温升高,并查到裂殖体和虫体。其中0345号羊系先感染山东栖霞市地区的饥饿雌性成蜱300只(实际叮咬138只),10d后补放入甘肃地区饥饿成蜱200只(实际叮咬150只)。因该羊未出现明显的临床症状和体温反应,也未查到裂殖体,40d后仅表现出一般带虫水平(红细胞染虫率在3%以下),故判为未发病。2.2体温变化发病羊均有体温2次升高至40℃以上的反应,呈稽留热型,个别也呈间歇热、弛张热,第1次高温持续时间为1...