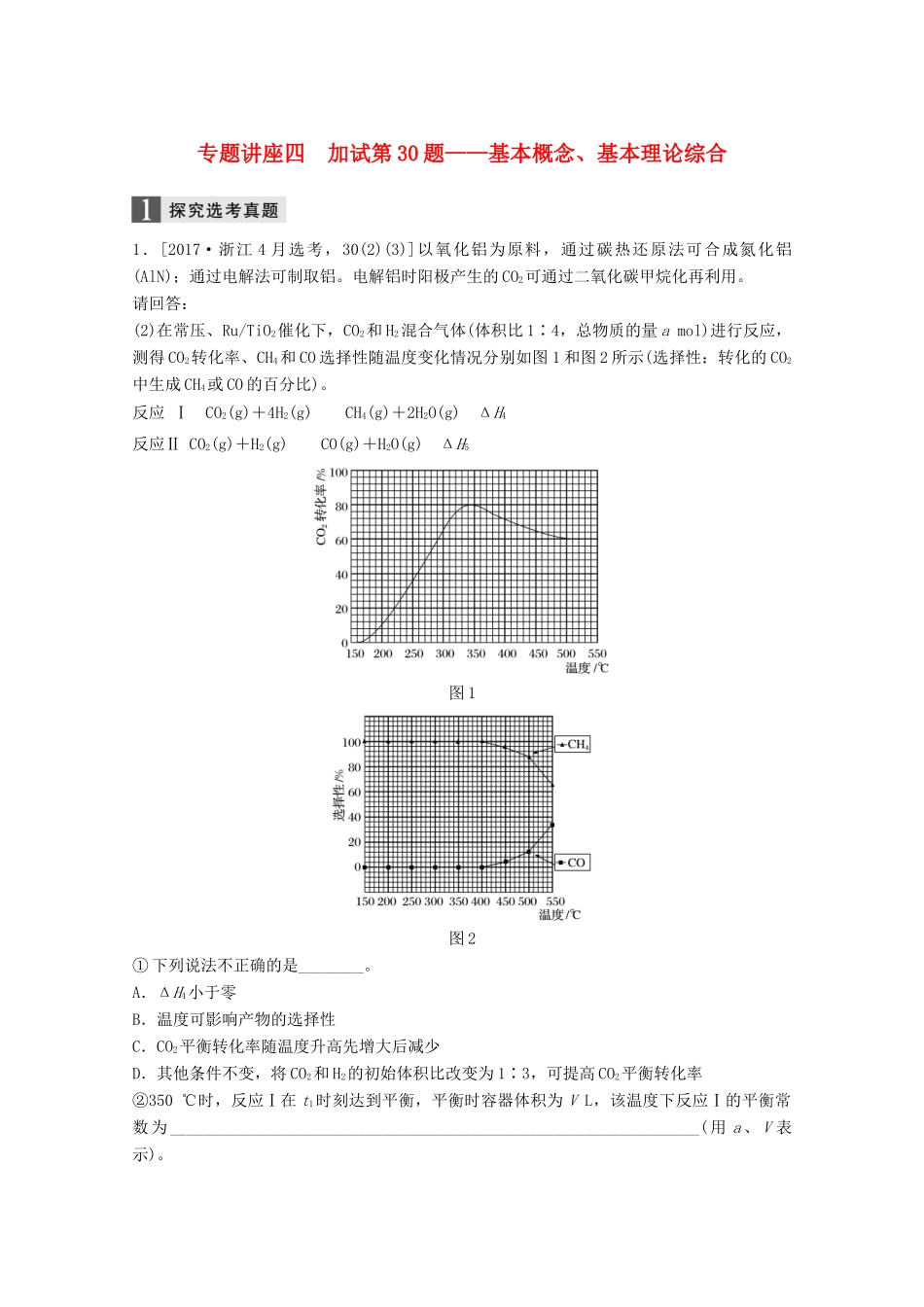
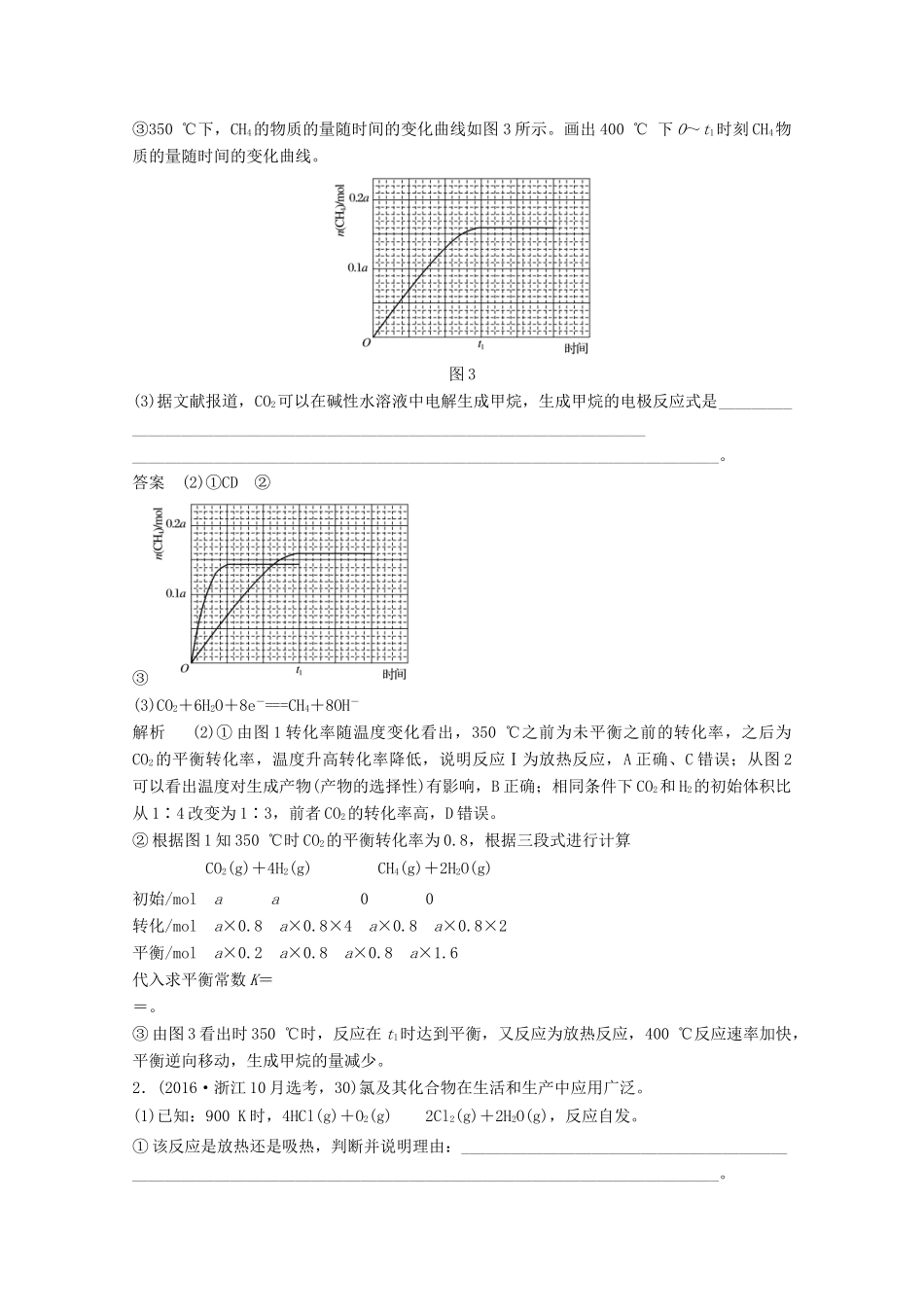
专题讲座四加试第30题——基本概念、基本理论综合1.[2017·浙江4月选考,30(2)(3)]以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。请回答:(2)在常压、Ru/TiO2催化下,CO2和H2混合气体(体积比1∶4,总物质的量amol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。反应ⅠCO2(g)+4H2(g)CH4(g)+2H2O(g)ΔH4反应ⅡCO2(g)+H2(g)CO(g)+H2O(g)ΔH5图1图2①下列说法不正确的是________。A.ΔH4小于零B.温度可影响产物的选择性C.CO2平衡转化率随温度升高先增大后减少D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应Ⅰ的平衡常数为_________________________________________________________________(用a、V表示)。③350℃下,CH4的物质的量随时间的变化曲线如图3所示。画出400℃下O~t1时刻CH4物质的量随时间的变化曲线。图3(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是________________________________________________________________________________________________________________________________________________。答案(2)①CD②③(3)CO2+6H2O+8e-===CH4+8OH-解析(2)①由图1转化率随温度变化看出,350℃之前为未平衡之前的转化率,之后为CO2的平衡转化率,温度升高转化率降低,说明反应Ⅰ为放热反应,A正确、C错误;从图2可以看出温度对生成产物(产物的选择性)有影响,B正确;相同条件下CO2和H2的初始体积比从1∶4改变为1∶3,前者CO2的转化率高,D错误。②根据图1知350℃时CO2的平衡转化率为0.8,根据三段式进行计算CO2(g)+4H2(g)CH4(g)+2H2O(g)初始/molaa00转化/mola×0.8a×0.8×4a×0.8a×0.8×2平衡/mola×0.2a×0.8a×0.8a×1.6代入求平衡常数K==。③由图3看出时350℃时,反应在t1时达到平衡,又反应为放热反应,400℃反应速率加快,平衡逆向移动,生成甲烷的量减少。2.(2016·浙江10月选考,30)氯及其化合物在生活和生产中应用广泛。(1)已知:900K时,4HCl(g)+O2(g)2Cl2(g)+2H2O(g),反应自发。①该反应是放热还是吸热,判断并说明理由:________________________________________________________________________________________________________________。②900K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T(假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l)ΔH1=-102kJ·mol-13Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l)ΔH2=-422kJ·mol-1①写出在溶液中NaClO分解生成NaClO3的热化学方程式:__________________________。②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ctmol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=________(用c0、ct表示)mol·L-1。③有研究表明,生成NaClO3的反应分两步进行:Ⅰ.2ClO-===ClO+Cl-Ⅱ.ClO+ClO-===ClO+Cl-常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:______________________________________________________________________________________________________________________________________________。(3)电解NaClO3水溶液可制备NaClO4。在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降。为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式:____________________________。答案(1)①放热反应,ΔS<0且反应自发②(2)①3NaClO(aq)===2NaCl(aq)+NaClO3(aq)ΔH=...