化学反应速率与化学平衡图像解题方法1.化学平衡图像题的思维流程2.解题步骤3.解题技巧(1)“定一议二”原则在化学平衡图像中,了解纵轴、横轴和曲线所表示的三个物理量的意义。在确定横轴所表示的物理量后,讨论纵轴与曲线的关系,或在确定纵轴所表示的物理量后,讨论横轴与曲线的关系。如反应2A(g)+B(g)2C(g)达到化学平衡时,A的平衡转化率与压强和温度的关系如图1所示[纵轴为A的平衡转化率(α),横轴为反应温度(T)]。定压看温度变化,升高温度曲线走势降低,说明A的转化率降低,平衡向逆反应方向移动,正反应是放热反应。定温看压强变化,因为此反应是反应后气体体积减小的反应,压强增大,平衡向正反应方向移动,A的转化率增大,故p2>p1。(2)“先拐先平数值大”原则对于同一化学反应在化学平衡图像中,先出现拐点的反应先达到平衡状态,相应曲线对应的反应速率大,所以先出现拐点的曲线表示的温度较高(如图2所示,α表示反应物的转化率)或压强较大[如图3所示,φ(A)表示反应物A的体积分数]。图2:T2>T1,正反应放热。图3:p1
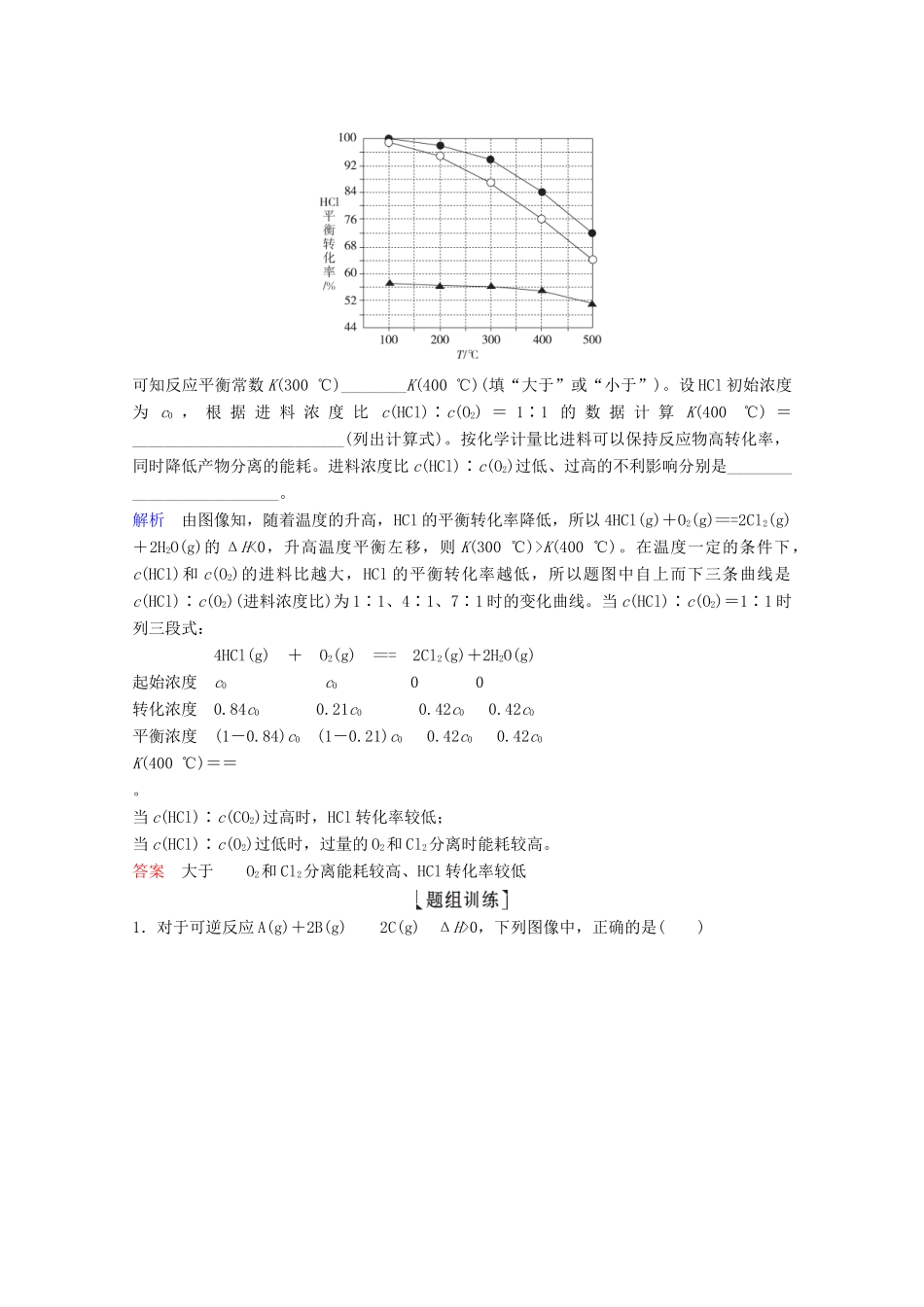
T2B.a点的反应速率小于c点的反应速率C.a点的正反应速率大于b点的逆反应速率D.b点时二聚体的浓度为0.45mol·L-1解析由图像的变化趋势可看出T2时,环戊二烯浓度的变化趋势大,反应速率快,因此T2大于T1,A错误;影响反应速率的因素有温度和环戊二烯的浓度等,a点温度低,但环戊二烯浓度大,c点温度高但环戊二烯浓度小,故无法比较a、c点速率大小,B错误;相同温度下,随着时间的延长,反应物的浓度逐渐减小,反应速率逐渐减小,因此a点的正反应速率大于b点的逆反应速率,C正确;由图像知,开始时环戊二烯的浓度为1.5mol·L-1,b点时的浓度为0.6mol·L-1,则环戊二烯转化的物质的量浓度为0.9mol·L-1,则二聚体的浓度为=0.45mol·L-1。答案CD(2019·全国卷Ⅲ节选)Deacon发明的直接氧化法为:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:可知反应平衡常数K(300℃)________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=__________________________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是__________________________。解析由图像知,随着温度的升高,HCl的平衡转化率降低,所以4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)的ΔH<0,升高温度平衡左移,则K(300℃)>K(400℃)。在温度一定的条件下,c(HCl)和c(O2)的进料比越大,HCl的平衡转化率越低,所以题图中自上而下三条曲线是c(HCl)∶c(O2)(进料浓度比)为1∶1、4∶1、7∶1时的变化曲线。当c(HCl)∶c(O2)=1∶1时列三段式:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)起始浓度c0c000转化浓度0.84c00.21c00.42c00.42c0平衡浓度(1-0.84)c0(1-0.21)c00.42c00.42c0K(400℃)==。当c(HCl)∶c(CO2)过高时,HCl转化率较低;当c(HCl)∶c(O2)过低时,过量的O2和Cl2分离时能耗较高。答案大于O2和Cl2分离能耗较高、HCl转化率较低1.对于可逆反应A(g)+2B(g)2C(g)ΔH>0,下列图像中,正确的是()答案A解析该反应的正反应为吸热反应,升高温度,平衡正向移动,A%减小,A正确;该反应的正反应为吸热反应,升高温度,v(正)、v(逆)均增大,平衡正向移动,则v(正)>v(逆),B错误;升高温度,反应速率加快,达到平衡的时间缩短,C错误;平衡后,增大压强,v(正)、v(逆)均增大,平衡正向移动,则v(正)>v(逆),D错误。2.(2019·江苏高考)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:反应Ⅰ:CO2(g)+H2(g)===CO(g)+H2O(g)ΔH=41....