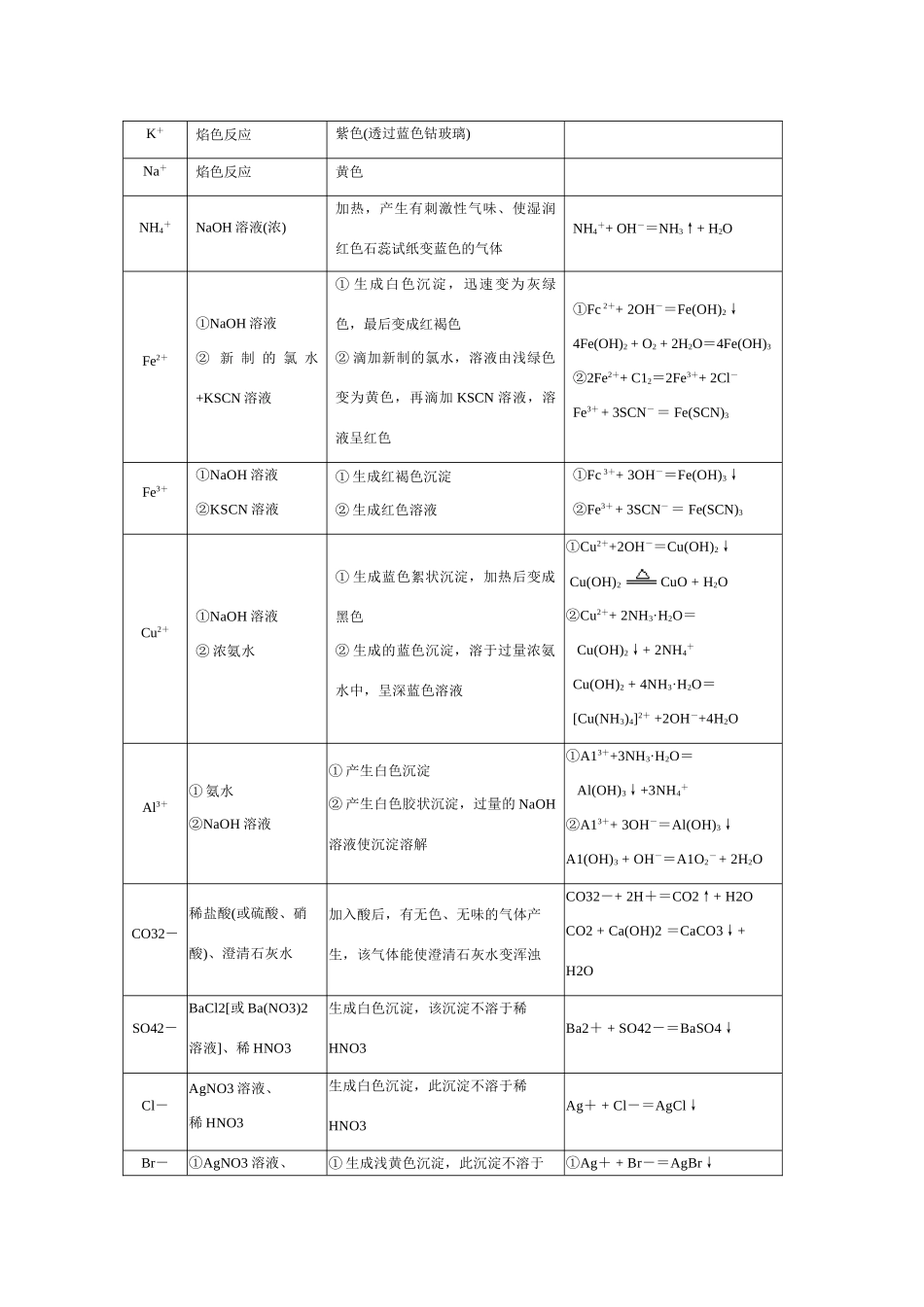
第三节物质检验实验方案的设计教案教学目的1.使学生进一步掌握常见阴离子和阳离子的检验方法。2.使学生学习未知物检验的一般方法。3.使学生通过对已知物质中所含离子的检验及未知物的检验,进一步了解实验方案的设计原理和方法。课时安排:2课时第一课时离子的检验第二课时来知物的检验教学用具:投影仪,试管,氯化钾、硫酸钾、亚硫酸钾、稀硝酸、氯化钡溶液。教学方法:讨论,归钠,总结。预习提纲请确定CO32-,SO42-、C1—、Br—、I—、K+、Na+、NH4+、Fe3+、AL3+等10种常见离子检验的试剂,说明反应中各有什么实验现象,并写出相应的离子方程式。教学过程:第一课时教师讲授:物质的检验分两类,一是确定成分,既物质的鉴定,二是使物质区分,既物质的鉴别.对物质进行检验时,一般分为三个步骤:首先,观察物质的状态、颜色、气体的气味、是否有白雾(溶解性)然后是准备试样,当试样是固体时,应先取少量试样配成溶液,观察是否溶解、是否有气体产生等,以初步确定物质的组成。最后进行检验,去配好的溶液进行实验时每次应移取少量,绝不能将检测试剂直接全部加入到全部待测溶液中[板书]一、离子的检验[投影]投影部分学生课下完成的10种常见离子检验的试剂、反应现象、离子方程式图表。[教师]引导学生从反应是否简单快捷;现象是否明显;是否有其他离子干扰等方面评价。待学生评价后,师生共同总结归纳。[投影]教材中表6-1常见离子的检验方法。K+焰色反应紫色(透过蓝色钴玻璃)Na+焰色反应黄色NH4+NaOH溶液(浓)加热,产生有刺激性气味、使湿润红色石蕊试纸变蓝色的气体NH4++OH-=NH3↑+H2OFe2+①NaOH溶液②新制的氯水+KSCN溶液①生成白色沉淀,迅速变为灰绿色,最后变成红褐色②滴加新制的氯水,溶液由浅绿色变为黄色,再滴加KSCN溶液,溶液呈红色①Fc2++2OH-=Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)3②2Fe2++C12=2Fe3++2Cl-Fe3++3SCN-=Fe(SCN)3Fe3+①NaOH溶液②KSCN溶液①生成红褐色沉淀②生成红色溶液①Fc3++3OH-=Fe(OH)3↓②Fe3++3SCN-=Fe(SCN)3Cu2+①NaOH溶液②浓氨水①生成蓝色絮状沉淀,加热后变成黑色②生成的蓝色沉淀,溶于过量浓氨水中,呈深蓝色溶液①Cu2++2OH-=Cu(OH)2↓Cu(OH)2CuO+H2O②Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2OAl3+①氨水②NaOH溶液①产生白色沉淀②产生白色胶状沉淀,过量的NaOH溶液使沉淀溶解①A13++3NH3·H2O=Al(OH)3↓+3NH4+②A13++3OH-=Al(OH)3↓A1(OH)3+OH-=A1O2-+2H2OCO32-稀盐酸(或硫酸、硝酸)、澄清石灰水加入酸后,有无色、无味的气体产生,该气体能使澄清石灰水变浑浊CO32-+2H+=CO2↑+H2OCO2+Ca(OH)2=CaCO3↓+H2OSO42-BaCl2[或Ba(NO3)2溶液]、稀HNO3生成白色沉淀,该沉淀不溶于稀HNO3Ba2++SO42-=BaSO4↓Cl-AgNO3溶液、稀HNO3生成白色沉淀,此沉淀不溶于稀HNO3Ag++Cl-=AgCl↓Br-①AgNO3溶液、①生成浅黄色沉淀,此沉淀不溶于①Ag++Br-=AgBr↓稀HNO3②新制的氯水、四氯化碳稀HNO3②溶液由无色变为橙色,加CCl4振荡后,CCl4层变为橙红色②2Br-+Cl2=Br2+2C1-I-①AgNO3溶液、稀HNO3②新制的氯水、四氯化碳③新制的氯水、淀粉溶液①生成黄色沉淀,此沉淀不溶于稀HNO3②溶液由无色变为黄色,加CCl4振荡后,CCl4层显紫红色③溶液显蓝色①Ag++I-=AgI↓②2I-+Cl2=I2+2C1-③2I-+Cl2=I2+2C1-[教师]启发引导学生从检验反应中生成物的状态、颜色等方面归纳离子检验的方法,然后师生共同小结。[小结]根据实验时生成物所表现出的现象不同,可把检验离子的方法归纳为三种类型:[板书]1.生成沉淀:如检验C1-离子、A13+离子:2.生成气体:如检验NH4+、CO32-离子3.显现特殊颜色:如检验Fe3+离子[练习]设计一个实验,证明硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H20]的成分中含有Fe2+、NH4+、SO42-和H20。教师提示:本实验的目的是设计实验,证明硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H20]的成分中含有Fe2+、NH4+、SO42-和H20。实验原理是根据离子的特征反应进行设计。先进行每个组分的单独检验,然后利用对各组的检验结果确定物质的组成。[讨论评价]学生分组讨论,...