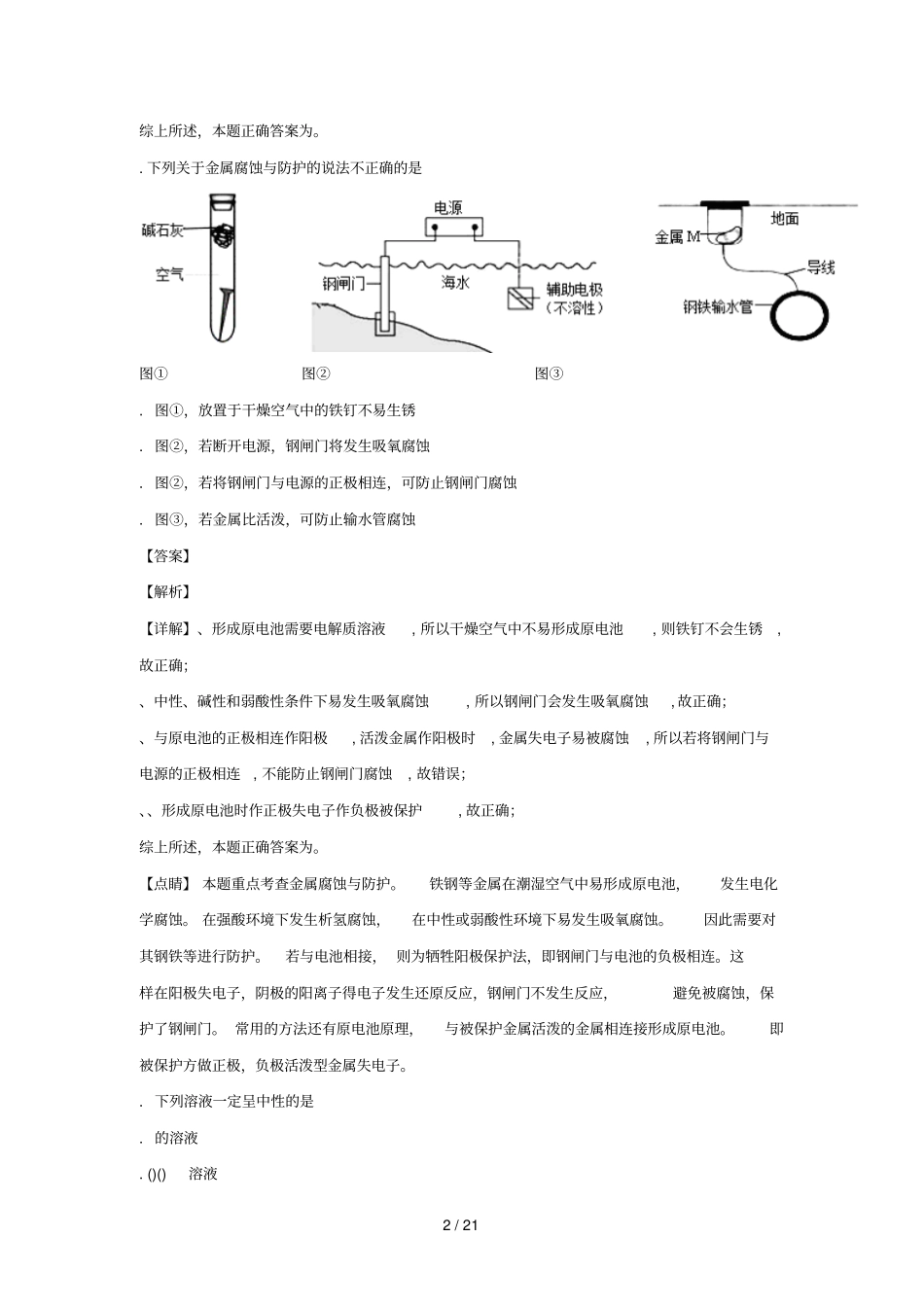
1/21北京中学学年下学期高二年级期末考试化学试卷本试卷分为Ⅰ卷、Ⅱ卷两部分,共个小题,满分分;答题时间为分钟;Ⅰ卷:选择题(共分)每小题只有一个选项符合题意。每小题分,共分。.下列能量的转化过程中,由化学能转化为电能的是铅蓄电池放电风力发电水力发电太阳能发电....【答案】【解析】【详解】、蓄电池放电,利用化学反应产生能量,将化学能转化为电能,故、正确;、风力发电,将风能转化为电能,故错误;、水力发电,将重力势能转化为电能,故错误;、太阳能发电,将太阳能转化为电能,故错误。综上所述,本题正确答案为。.下列化学用语正确的是.---.()↓.-.-【答案】【解析】【详解】、-在水溶液中既存在电离--,也存在水解--,以电离为主,所以-是酸性的;故错误;、水解为可逆过程,()↓,故错误;、碳酸氢钠是强电解质,溶于水完全电离成钠离子和碳酸氢根离子,-,故正确;、为弱酸,应分步电离-,--,故错误;2/21综上所述,本题正确答案为。.下列关于金属腐蚀与防护的说法不正确的是图①图②图③.图①,放置于干燥空气中的铁钉不易生锈.图②,若断开电源,钢闸门将发生吸氧腐蚀.图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀.图③,若金属比活泼,可防止输水管腐蚀【答案】【解析】【详解】、形成原电池需要电解质溶液,所以干燥空气中不易形成原电池,则铁钉不会生锈,故正确;、中性、碱性和弱酸性条件下易发生吸氧腐蚀,所以钢闸门会发生吸氧腐蚀,故正确;、与原电池的正极相连作阳极,活泼金属作阳极时,金属失电子易被腐蚀,所以若将钢闸门与电源的正极相连,不能防止钢闸门腐蚀,故错误;、、形成原电池时作正极失电子作负极被保护,故正确;综上所述,本题正确答案为。【点睛】本题重点考查金属腐蚀与防护。铁钢等金属在潮湿空气中易形成原电池,发生电化学腐蚀。在强酸环境下发生析氢腐蚀,在中性或弱酸性环境下易发生吸氧腐蚀。因此需要对其钢铁等进行防护。若与电池相接,则为牺牲阳极保护法,即钢闸门与电池的负极相连。这样在阳极失电子,阴极的阳离子得电子发生还原反应,钢闸门不发生反应,避免被腐蚀,保护了钢闸门。常用的方法还有原电池原理,与被保护金属活泼的金属相连接形成原电池。即被保护方做正极,负极活泼型金属失电子。.下列溶液一定呈中性的是.的溶液.()()溶液3/21.使石蕊试液呈紫色的溶液.酸与碱恰好完全反应生成正盐的溶液【答案】【解析】试题分析:.的溶液不一定呈中性,如℃时,水的离子积常数是,时溶液呈中性,当时溶液呈碱性,故错误;.()()溶液,溶液的,溶液一定呈中性,故正确;.使石蕊试液呈紫色的溶液,常温下溶液显酸性或中性或碱性,故错误;.酸与碱恰好完全反应生成正盐的溶液,若是强酸强碱反应,溶液呈中性,若是强酸弱碱反应,溶液呈酸性,若是弱酸强碱反应溶液呈碱性,故错误;故选。考点:考查溶液酸碱性的判断.如图所示是时,与反应过程中能量变化的曲线图,下列叙述不正确的是.在温度、体积一定的条件下,通入和反应后放出的热量为.曲线是加入催化剂时的能量变化曲线.加入催化剂,也不能提高的转化率.该反应的热化学方程式为:()()()△﹣【答案】【解析】【详解】、该反应是可逆反应,反应存在一定限度,在温度、体积一定的条件下,通入和充分反应后放出的热量小于,故错误;、催化剂能改变反应的路径,使发生反应所需的活化能降低,因此曲线是加入催化剂时的能量变化曲线,故正确;、催化剂能改变反应速率,但不能改变化学平衡,所以加入催化剂,也不能提高的转化率,故正确;、该反应放出的能量大于吸收的能量,所以放热,书写热化学方程式必须标注物质的聚集状4/21态,该热化学方程式未标注物质的状态,故正确。综上所述,本题正确答案为。.下列实验事实不能用平衡移动原理解释的是.的氨水稀释倍后溶液>.将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体.对()()(),减小容器体积,气体颜色变深.水垢中含有,可先用溶液浸泡处理,而后用盐酸去除【答案】【解析】【详解】、本来稀释倍碱性变弱倍应该是.但是,氨水属于弱碱,弱碱部分电离加水稀释平衡正向移动,碱性稍大些,所以...