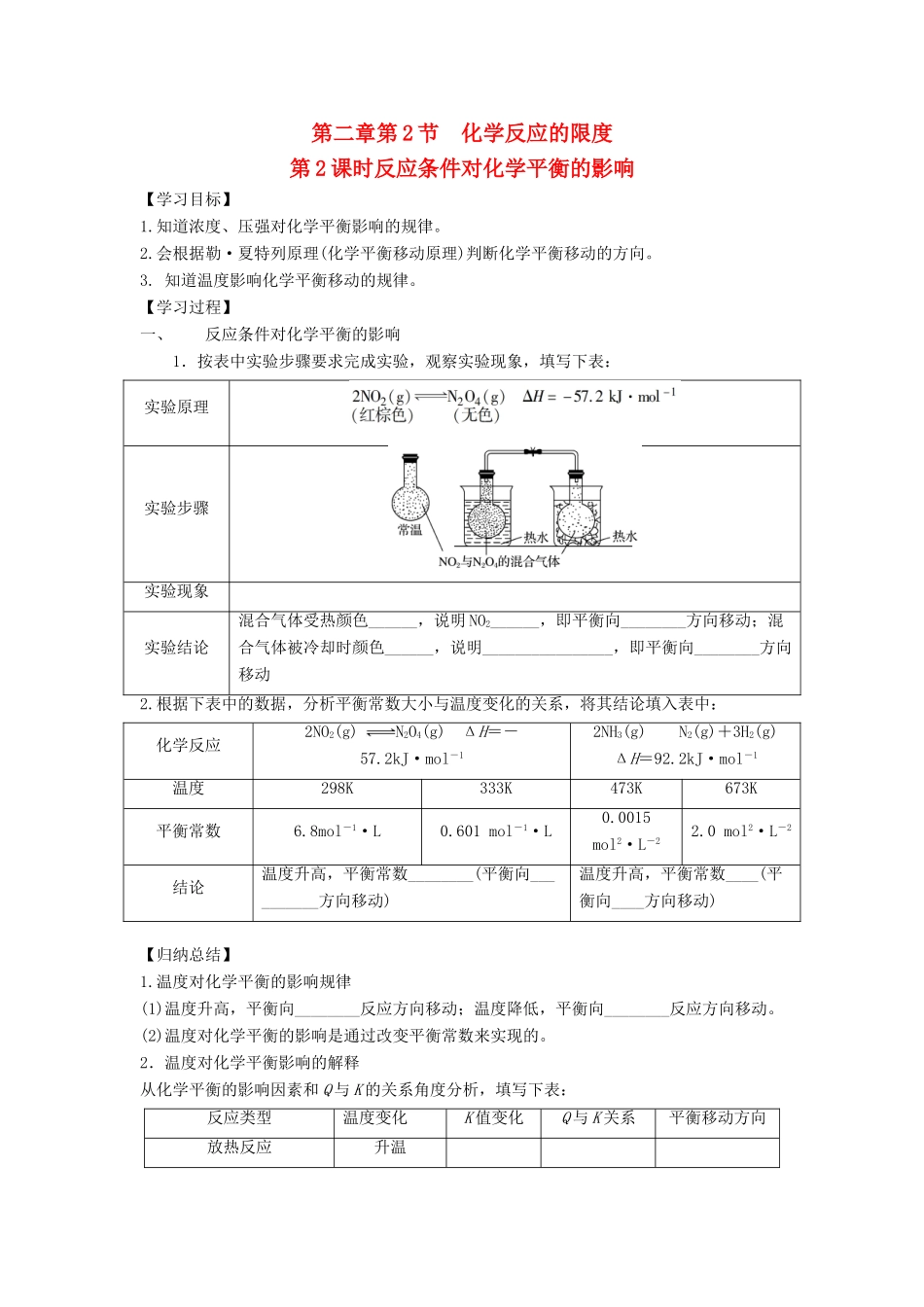
第二章第2节化学反应的限度第2课时反应条件对化学平衡的影响【学习目标】1.知道浓度、压强对化学平衡影响的规律。2.会根据勒·夏特列原理(化学平衡移动原理)判断化学平衡移动的方向。3.知道温度影响化学平衡移动的规律。【学习过程】一、反应条件对化学平衡的影响1.按表中实验步骤要求完成实验,观察实验现象,填写下表:实验原理实验步骤实验现象实验结论混合气体受热颜色______,说明NO2______,即平衡向________方向移动;混合气体被冷却时颜色______,说明________________,即平衡向________方向移动2.根据下表中的数据,分析平衡常数大小与温度变化的关系,将其结论填入表中:化学反应2NO2(g)N2O4(g)ΔH=-57.2kJ·mol-12NH3(g)N2(g)+3H2(g)ΔH=92.2kJ·mol-1温度298K333K473K673K平衡常数6.8mol-1·L0.601mol-1·L0.0015mol2·L-22.0mol2·L-2结论温度升高,平衡常数________(平衡向__________方向移动)温度升高,平衡常数____(平衡向____方向移动)【归纳总结】1.温度对化学平衡的影响规律(1)温度升高,平衡向________反应方向移动;温度降低,平衡向________反应方向移动。(2)温度对化学平衡的影响是通过改变平衡常数来实现的。2.温度对化学平衡影响的解释从化学平衡的影响因素和Q与K的关系角度分析,填写下表:反应类型温度变化K值变化Q与K关系平衡移动方向放热反应升温降温吸热反应升温二、浓度对化学平衡的影响1.按表中实验要求完成实验,将有关实验现象及其结论填入表中:原理Fe3++3SCN-Fe(SCN)3(红色)实验(1)步骤现象溶液颜色______溶液颜色______实验(2)步骤试管①中滴加0.01mol·L-1NaOH溶液0.01mol·L-1NaOH溶液现象溶液颜色______溶液颜色______实验结论增大c(Fe3+)或c(SCN-)后,Fe(SCN)3的浓度________,即化学平衡均向________方向移动;滴加NaOH溶液,由于_________________,使Fe3+的浓度________,Fe(SCN)3的浓度________,即化学平衡向________方向移动2.在一定条件下,反应Fe3++3SCN-Fe(SCN)3达到平衡状态,温度一定,平衡常数K为一定值。分析下列条件改变时浓度商Q的变化及平衡移动的方向,并填写下表:浓度变化Q值变化Q与K关系平衡移动方向增大反应物c(Fe3+)减小生成物c[Fe(SCN)3]减小反应物c(Fe3+)增大生成物c[Fe(SCN)3]【归纳总结】浓度对化学平衡的影响及注意事项(1)在其他条件不变的情况下,浓度对平衡移动的影响:①增大反应物浓度或减小生成物浓度时,QK,平衡向________________移动。(2)注意:①若其他条件不变,改变固体或纯液体反应物的用量,浓度商不变,Q=K,化学平衡不移动。如,可逆反应C(s)+H2O(g)CO(g)+H2(g)在某温度下达到平衡后,增加或移去一部分碳单质固体,化学平衡不移动。②作为离子反应,只有改变实际参加反应的离子浓度,才对平衡有影响,像FeCl3+3KSCNFe(SCN)3+3KCl,增加KCl固体的量,平衡不移动,因为KCl不参与离子反应。【归纳总结】浓度对化学平衡的影响及注意事项(1)在其他条件不变的情况下,浓度对平衡移动的影响:①增大反应物浓度或减小生成物浓度时,QK,平衡向________________移动。(2)注意:①若其他条件不变,改变固体或纯液体反应物的用量,浓度商不变,Q=K,化学平衡不移动。如,可逆反应C(s)+H2O(g)CO(g)+H2(g)在某温度下达到平衡后,增加或移去一部分碳单质固体,化学平衡不移动。②作为离子反应,只有改变实际参加反应的离子浓度,才对平衡有影响,像FeCl3+3KSCNFe(SCN)3+3KCl,增加KCl固体的量,平衡不移动,因为KCl不参与离子反应。三、压强对化学平衡的影响1.按表中实验要求完成实验,将有关实验现象及其结论填入表中:实验原理N2O4(g)2NO2(g)(红棕色)Δνg>0实验操作三支针筒中均抽入10cm3NO2气体,将针筒前端封闭将第二支针筒活塞迅速推至5cm3处(体积减小,压强增大)将第三支针筒活塞迅速拉至20cm3处(体积增大,压强减小)实验现象气体颜色____________气体颜色___________实验结论压强增大...