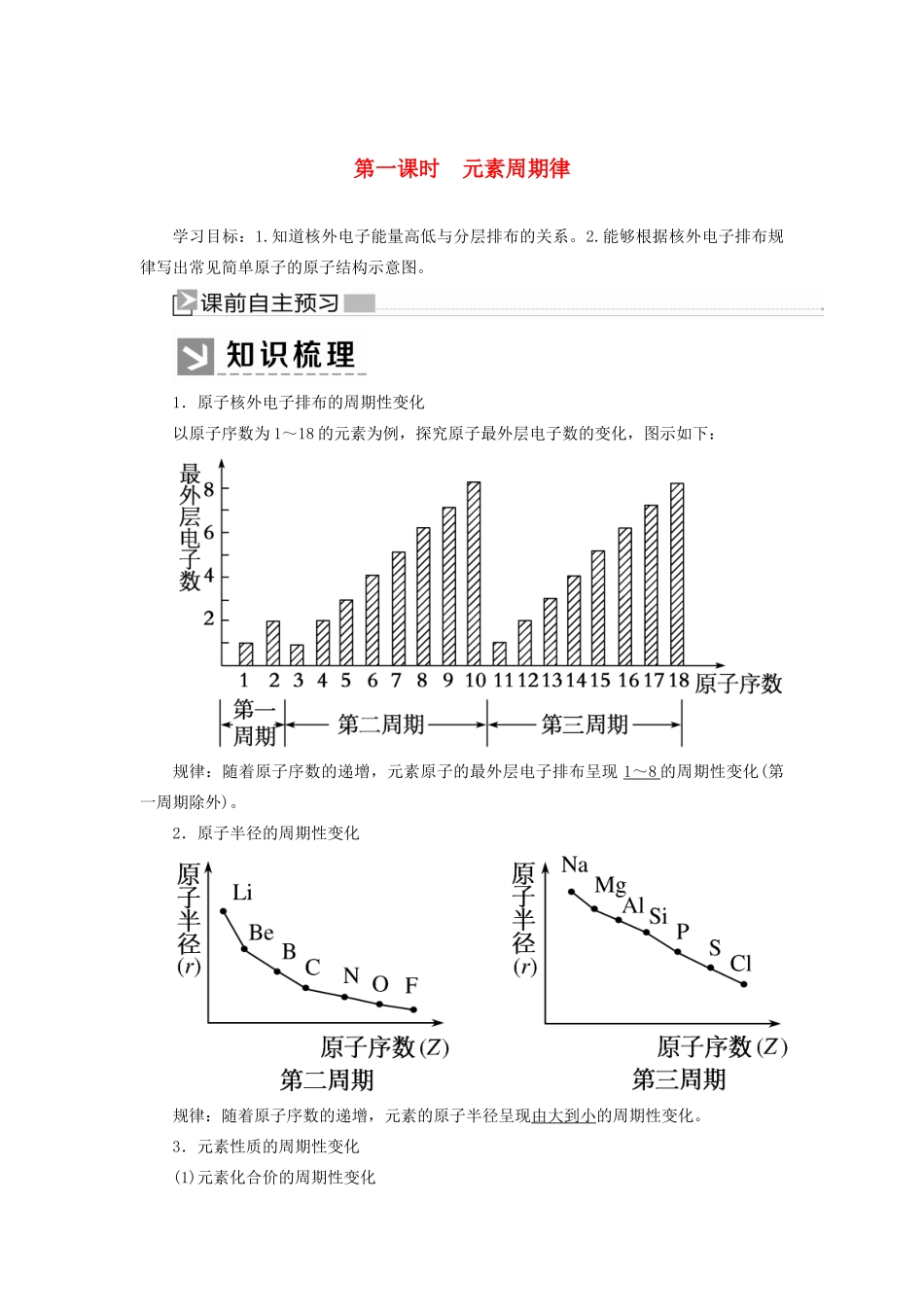
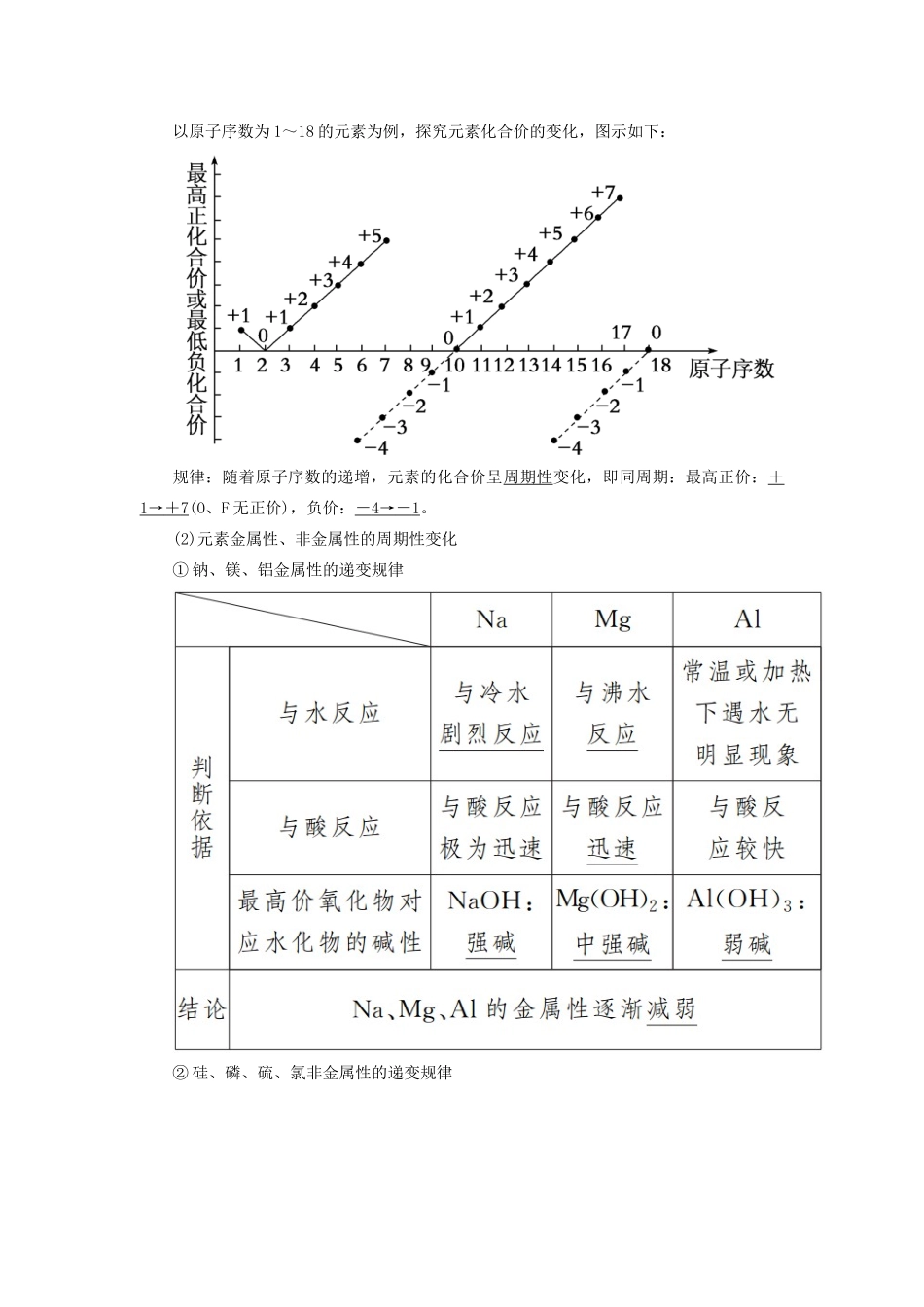
第一课时元素周期律学习目标:1.知道核外电子能量高低与分层排布的关系。2.能够根据核外电子排布规律写出常见简单原子的原子结构示意图。1.原子核外电子排布的周期性变化以原子序数为1~18的元素为例,探究原子最外层电子数的变化,图示如下:规律:随着原子序数的递增,元素原子的最外层电子排布呈现1~8的周期性变化(第一周期除外)。2.原子半径的周期性变化规律:随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。3.元素性质的周期性变化(1)元素化合价的周期性变化以原子序数为1~18的元素为例,探究元素化合价的变化,图示如下:规律:随着原子序数的递增,元素的化合价呈周期性变化,即同周期:最高正价:+1→+7(O、F无正价),负价:-4→-1。(2)元素金属性、非金属性的周期性变化①钠、镁、铝金属性的递变规律②硅、磷、硫、氯非金属性的递变规律(3)同周期元素性质递变规律(4)元素周期律①内容元素的性质随着原子序数的递增而呈周期性变化。②实质元素性质的周期性变化是原子核外电子排布周期性变化的必然结果。1.判断正误(正确的打“√”,错误的打“×”)(1)随着原子序数的递增,最外层电子排布均呈现由1个电子递增至8个电子的周期性变化()(2)原子序数越大,原子半径一定越小()(3)在化合物中金属元素只显正化合价,非金属元素只显负化合价()(4)任何元素均有正价和负价()(5)金属性、非金属性强弱从根本上取决于其原子核外电子的排布情况()[答案](1)×(2)×(3)×(4)×(5)√2.下列有关原子结构和元素周期律的表述正确的是()A.同周期非金属元素的氧化物对应的水化物的酸性从左到右依次增强B.第ⅠA族元素的金属性比第ⅡA族元素的金属性强C.ⅦA族元素是同周期中非金属性最强的元素D.原子序数为15的元素的最高化合价为+3[解析]在同周期中,非金属元素的最高价氧化物对应水化物的酸性从左到右依次增强,A项错误;同周期的第ⅠA族和第ⅡA族的金属元素比较,第ⅠA族的元素比第ⅡA族的元素的金属性强,但不同周期的是无法比较的,如Ca的金属性比Na的金属性强,B项错误;ⅦA族元素是同周期中非金属性最强的元素,C项正确;原子序数为15的元素是P,最外层电子数为5,则最高化合价为+5价,D项错误;答案选C。[答案]C3.不能用元素周期律解释的是()A.酸性HCl>H2S>PH3B.原子半径P>S>ClC.最高正价Cl>S>PD.酸性HClO4>H2SO4>H3PO4[解析]氢化物的酸性与元素在同一周期、同一主族没有递变性和规律性,不能用周期律解释,元素的非金属性与最高价氧化物对应的水化物的酸性有关,故A符合题意;同周期元素从左到右原子半径减小,则原子半径P>S>Cl,可解释,故B不符合题意;Cl、S、P的最外层电子数分别为7、6、5,最高正价为+7、+6、+5,最高正价为Cl>S>P,故C不符合题意;非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,酸性强弱顺序是HClO4>H2SO4>H3PO4,故D不符合题意。[答案]A知识点一元素原子结构的周期性变化粒子半径大小的比较方法(1)同周期——“序大径小”①方法:同周期,从左到右,随着原子序数的递增,原子半径逐渐减小。②实例:11~17号元素r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。(2)同主族——“序大径大”①方法:同主族,从上到下,随着原子序数的递增,原子半径逐渐增大。②实例:r(Li)
r(Cl)。②同种元素不同价态的阳离子半径比较规律——“数大径小”。带电荷数越多,粒子半径越小。如r(Fe3+)r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。【典例1】下列粒子半径大小比较正确的是()A.Na+Cl->Na+>Al3+C.Na