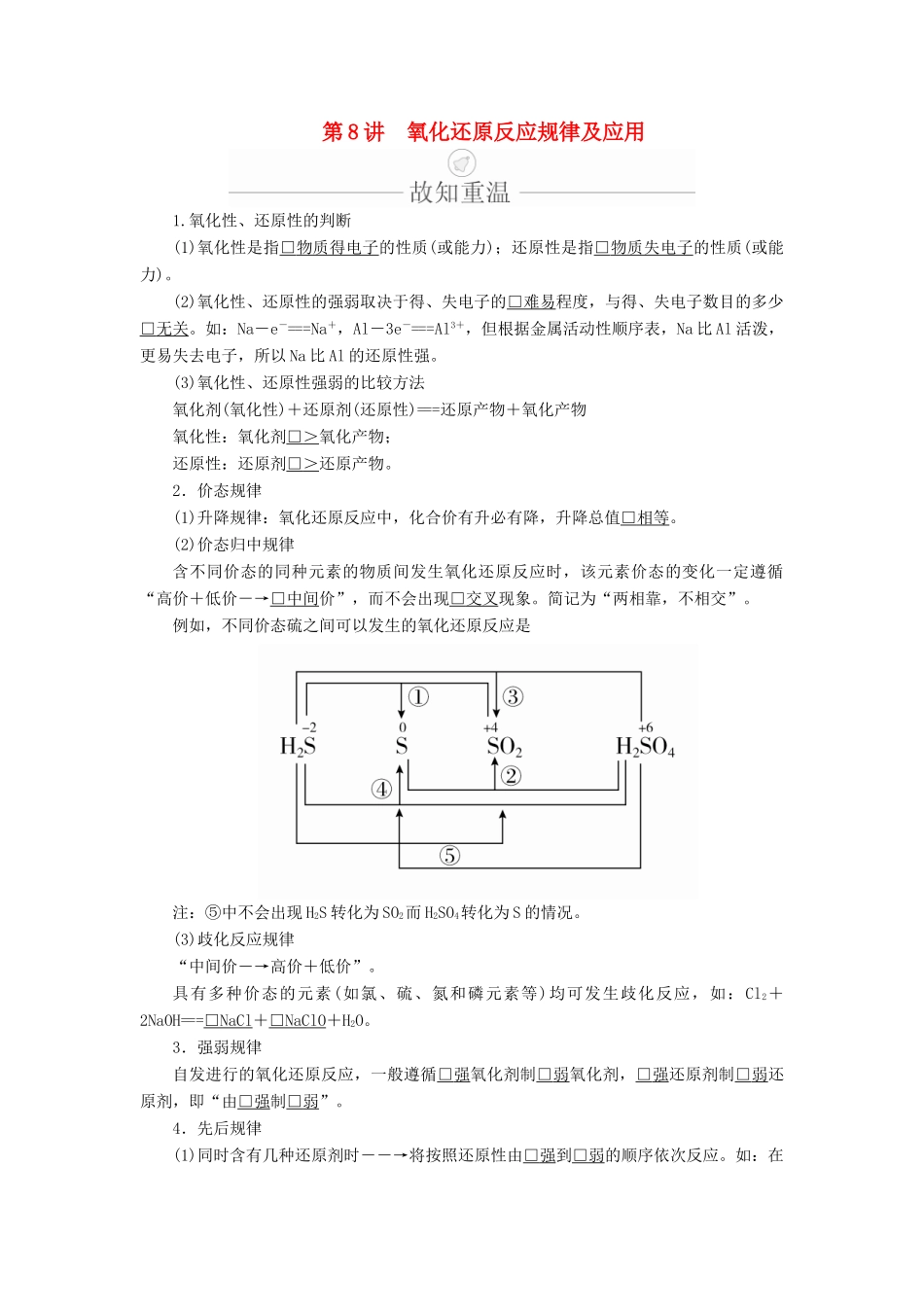
第8讲氧化还原反应规律及应用1.氧化性、还原性的判断(1)氧化性是指□物质得电子的性质(或能力);还原性是指□物质失电子的性质(或能力)。(2)氧化性、还原性的强弱取决于得、失电子的□难易程度,与得、失电子数目的多少□无关。如:Na-e-===Na+,Al-3e-===Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。(3)氧化性、还原性强弱的比较方法氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物氧化性:氧化剂□>氧化产物;还原性:还原剂□>还原产物。2.价态规律(1)升降规律:氧化还原反应中,化合价有升必有降,升降总值□相等。(2)价态归中规律含不同价态的同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价―→□中间价”,而不会出现□交叉现象。简记为“两相靠,不相交”。例如,不同价态硫之间可以发生的氧化还原反应是注:⑤中不会出现H2S转化为SO2而H2SO4转化为S的情况。(3)歧化反应规律“中间价―→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl2+2NaOH===□NaCl+□NaClO+H2O。3.强弱规律自发进行的氧化还原反应,一般遵循□强氧化剂制□弱氧化剂,□强还原剂制□弱还原剂,即“由□强制□弱”。4.先后规律(1)同时含有几种还原剂时――→将按照还原性由□强到□弱的顺序依次反应。如:在FeBr2溶液中通入少量Cl2时,因为还原性Fe2+□>Br-,所以□Fe2+先与Cl2反应。(2)同时含有几种氧化剂时――→将按照氧化性由□强到□弱的顺序依次反应。如在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性Fe3+□>Cu2+□>H+,所以铁粉先与□Fe3+反应,然后依次为□Cu2+、□H+。5.得失电子守恒规律(1)氧化还原反应中,氧化剂□得电子总数等于还原剂□失电子总数。(2)应用:运用“守恒规律”可进行氧化还原反应方程式的配平和相关计算。1.判断正误,正确的画“√”,错误的画“×”,并指明错因。(1)金属失去的电子数越多,金属的还原性越强。(×)错因:金属还原性强弱取决于其失电子的难易程度,与失电子多少无关。(2)SO2具有较强的还原性,浓H2SO4具有强氧化性,故二者能发生氧化还原反应。(×)错因:硫元素没有介于+4价和+6价之间的价态,不能发生反应。(3)同一元素不同价态的化合物中,元素的化合价越高,物质的氧化性越强。(×)错因:由反应3NO2+H2O===2HNO3+NO可知氧化性:NO2>HNO3。(4)含有最高价元素的化合物一定具有强氧化性。(×)错因:Na+、CO2中的碳元素均处于最高价,但不具有强氧化性。(5)反应:KClO3+6HCl===KCl+3Cl2+3H2O转移的电子数为6e-。(×)错因:转移的电子数为5e-。(6)强氧化剂与强还原剂混合一定能发生氧化还原反应。(×)错因:SO2是强还原剂,浓H2SO4是强氧化剂,但二者不反应。2.水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O+O2+aOH-===Y+S4O+2H2O,下列有关说法不正确的是()A.a=4B.Y的化学式为Fe2O3C.S2O是还原剂D.每32gO2参加反应,转移电子的物质的量为4mol答案B解析由2S2O―→S4O,失去2mol电子,O2―→2O2-,得到4mol电子,由得失电子得失守恒知2Fe2+―→2Fe3+,失去2mol电子,再由原子守恒知,Y为四氧化三铁,B项错误。考点氧化性、还原性强弱的比较及应用[典例1](2018·延安质检)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是()A.3Cl2+6FeI2===2FeCl3+4FeI3B.Cl2+FeI2===FeCl2+I2C.Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2OD.2Fe3++2I-===2Fe2++I2解析根据氧化还原反应中,氧化性:氧化剂>氧化产物,可判断B中氧化性:Cl2>I2;C中氧化性:Co2O3>Cl2;D中氧化性:Fe3+>I2,这些结论与题给信息一致。对于A,由于I-的还原性强于Fe2+,所以Cl2应先氧化I-,而不应先氧化Fe2+。答案A名师精讲1.物质氧化性、还原性强弱判断的常用方法(1)根据化学方程式氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。(2)依据反应条件来判断当不同的氧化剂作用于同一还原剂时,若氧化产物价态相同,可依据反应条件的难易...