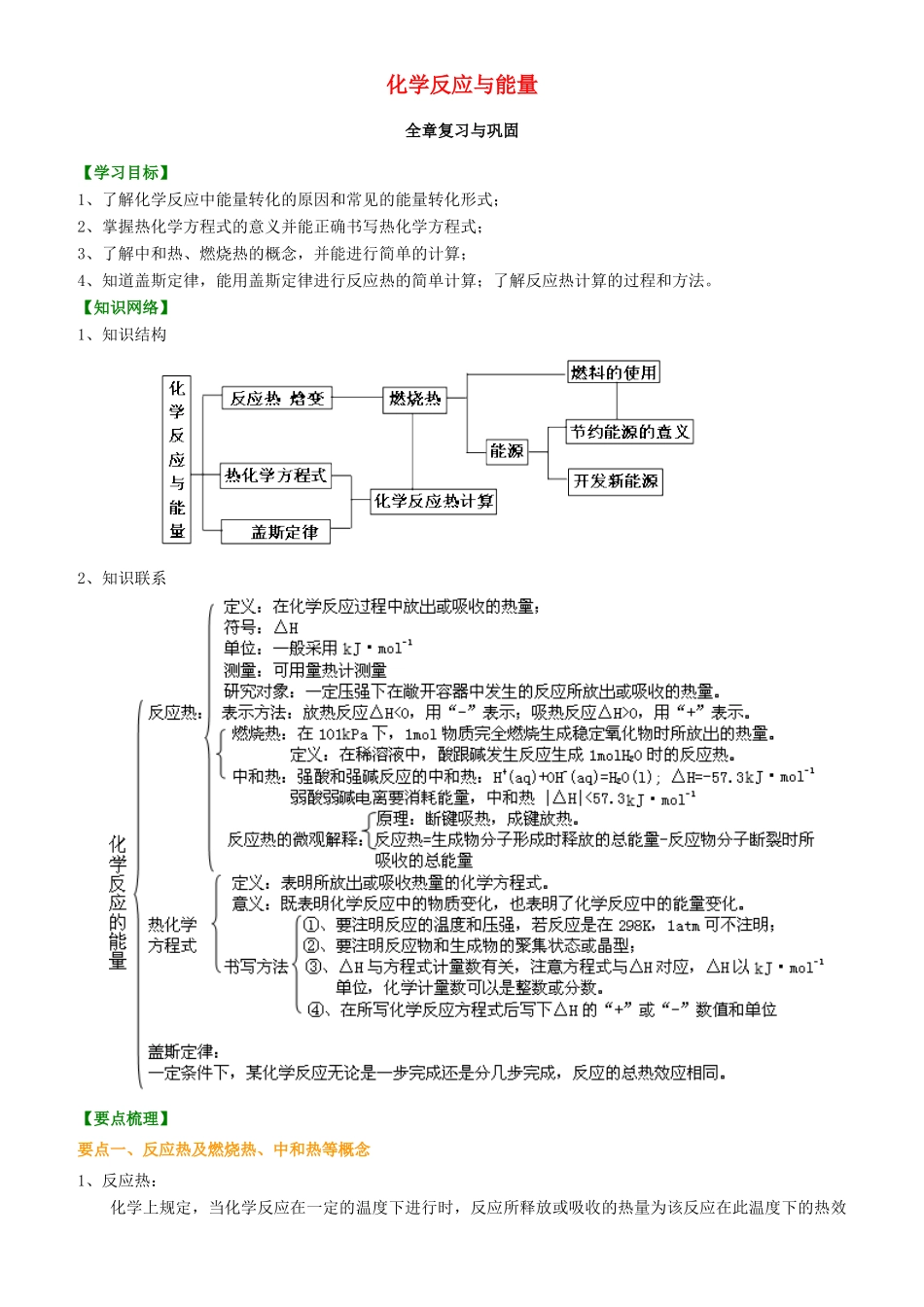
化学反应与能量全章复习与巩固【学习目标】1、了解化学反应中能量转化的原因和常见的能量转化形式;2、掌握热化学方程式的意义并能正确书写热化学方程式;3、了解中和热、燃烧热的概念,并能进行简单的计算;4、知道盖斯定律,能用盖斯定律进行反应热的简单计算;了解反应热计算的过程和方法。【知识网络】1、知识结构2、知识联系【要点梳理】要点一、反应热及燃烧热、中和热等概念1、反应热:化学上规定,当化学反应在一定的温度下进行时,反应所释放或吸收的热量为该反应在此温度下的热效应。2、燃烧热(1)概念:在101kPa时,1mol物质燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用kJ/mol表示。(2)表示的意义:例如C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。要点诠释:①规定是在101kPa压强下测出热量。书中提供的燃烧热数据都是在101kPa下测定出来的。因为压强不同,反应热有所不同。②规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数。例如,C8H18的燃烧热为5518kJ/mol,用热化学方程式表示则为C8H18(l)+O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ/mol③规定生成物为稳定的氧化物.例如C→CO2、H→H2O(l)、S→SO2等。C(s)+O2(g)=CO(g)△H=-110.5kJ/molC(s)+O2(g)=CO2(g)△H=-393.5kJ/molC的燃烧热为393.5kJ/mol而不是110.5kJ/mol。④叙述燃烧热时,用正值,在热化学方程式中用△H表示时取负值。例如,CH4的燃烧热为890.3kJ/mol,而△H=-890.3kJ/mol。必须以1mol可燃物燃烧为标准。3、中和热(1)概念:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫中和热。(2)中和热的表示:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol。要点诠释:①这里的稀溶液一般要求酸溶液中的c(H+)≤1mol/L,碱溶液中的c(OH-)≤1mol/L。这是因浓酸溶液和浓碱溶液相互稀释时会放出热量。②强酸与强碱的中和反应其实质是H+和OH-反应(即与酸、碱的种类无关),通过许多次实验测定,1molH+和1molOH-反应生成1molH2O时,放出热量57.3kJ。其热化学方程式为H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol因此,所有中和反应的△H都相同,都为-57.3kJ/mol。③中和热是以生成1molH2O为基准,因为表示中和热的热化学方程式中,水的化学计量数为1,其酸、碱或盐的化学计量数可以为分数;中和反应对象为稀溶液;强酸与强碱中和时生成1molH2O均放热57.3kJ,弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。4、中和热的测定(1)主要仪器:大烧杯(500mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。(2)实验步骤:①组装仪器如图6-1所示。②分别量取50mL0.50mol/L的盐酸和50mL0.55mol/LNaOH溶液,记录起始温度t1。③混合反应并准确量取混合液最高温度,记录终止温度t2。④重复实验二次,取平均值。⑤计算△H=(3)可能的误差①未及时测出最高温度——其值偏小②使用一个量筒且未洗干净——其值偏小③烧杯过大——其值偏小要点二、化学反应的焓变1、焓的定义物质所具有的能量是性质,符号为H。用焓变(△H)来描述与反应热有关的能量变化。△H=H(生成物)-H(反应物)△H为生成物的总焓与反应物的总焓之差,称为化学反应的焓变。注意:△H>0,表示吸热;△H<0,表示放热;单位:J/mol或kJ/mol2、反应热与焓变的关系热化学研究表明,对于等压条件下进行的化学反应,如果反应中物质的能量变化只转化成热能,而没有转化为电能、光能等其他形式的能,则该反应的反应热就等于反应前后物质的焓的改变。数学表达式:QP=H∆,其中:QP表示在压强不变的条件下化学反应的反应热。要点三、热化学方程式及其书写1、概念:能表示参加反应物质的量和反应热之间的关系的化学方程式。2、意义:既表明了化学反应中的物质变化,也表明了化学反应中的能量变化。要点诠释:(1).热化学方程式必须标出能量变化。(2).热化学方程式中必须标明反应物和生成物的聚集状态,因为反应热除跟物质的...