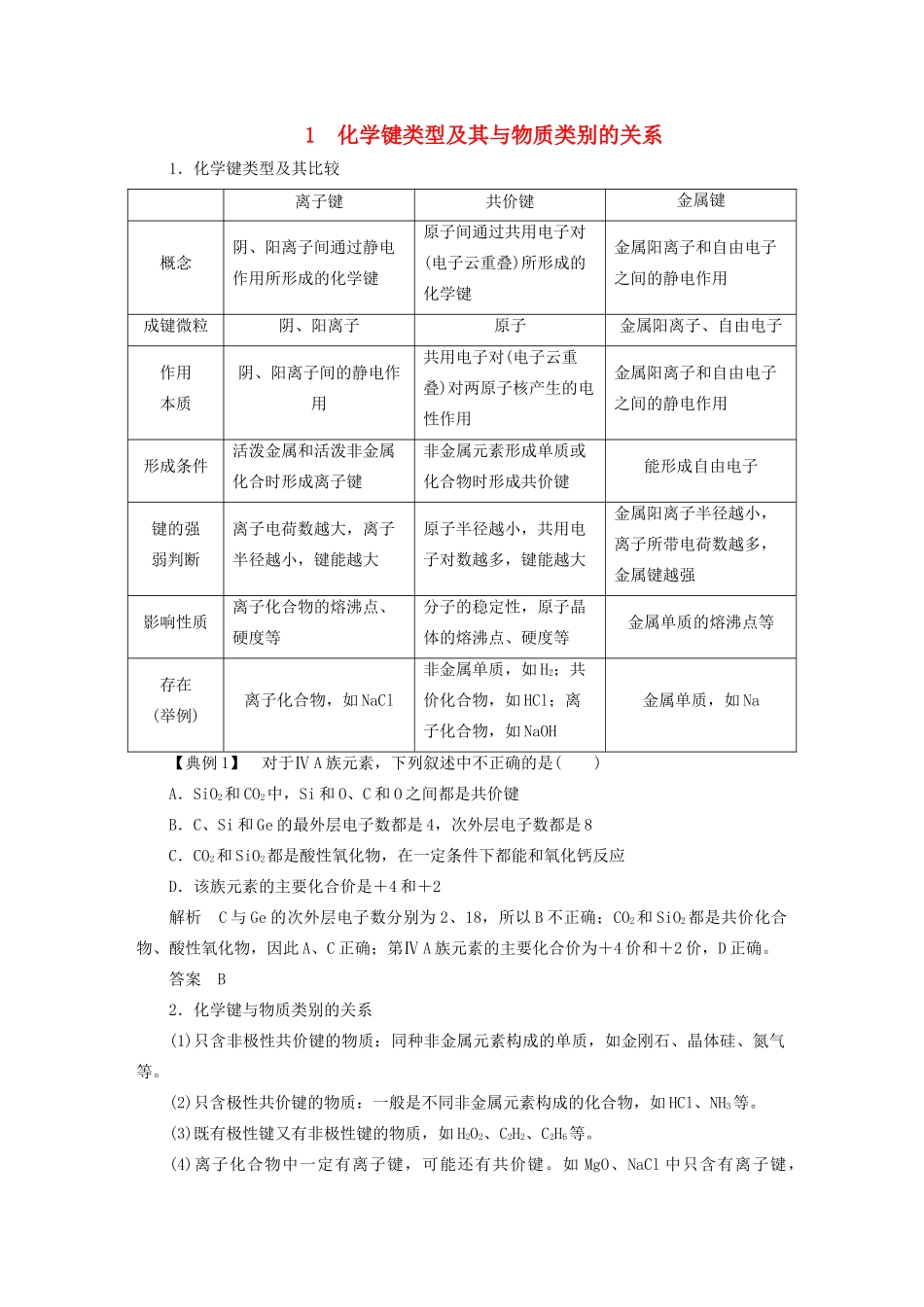
1化学键类型及其与物质类别的关系1.化学键类型及其比较离子键共价键金属键概念阴、阳离子间通过静电作用所形成的化学键原子间通过共用电子对(电子云重叠)所形成的化学键金属阳离子和自由电子之间的静电作用成键微粒阴、阳离子原子金属阳离子、自由电子作用本质阴、阳离子间的静电作用共用电子对(电子云重叠)对两原子核产生的电性作用金属阳离子和自由电子之间的静电作用形成条件活泼金属和活泼非金属化合时形成离子键非金属元素形成单质或化合物时形成共价键能形成自由电子键的强弱判断离子电荷数越大,离子半径越小,键能越大原子半径越小,共用电子对数越多,键能越大金属阳离子半径越小,离子所带电荷数越多,金属键越强影响性质离子化合物的熔沸点、硬度等分子的稳定性,原子晶体的熔沸点、硬度等金属单质的熔沸点等存在(举例)离子化合物,如NaCl非金属单质,如H2;共价化合物,如HCl;离子化合物,如NaOH金属单质,如Na【典例1】对于ⅣA族元素,下列叙述中不正确的是()A.SiO2和CO2中,Si和O、C和O之间都是共价键B.C、Si和Ge的最外层电子数都是4,次外层电子数都是8C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应D.该族元素的主要化合价是+4和+2解析C与Ge的次外层电子数分别为2、18,所以B不正确;CO2和SiO2都是共价化合物、酸性氧化物,因此A、C正确;第ⅣA族元素的主要化合价为+4价和+2价,D正确。答案B2.化学键与物质类别的关系(1)只含非极性共价键的物质:同种非金属元素构成的单质,如金刚石、晶体硅、氮气等。(2)只含极性共价键的物质:一般是不同非金属元素构成的化合物,如HCl、NH3等。(3)既有极性键又有非极性键的物质,如H2O2、C2H2、C2H6等。(4)离子化合物中一定有离子键,可能还有共价键。如MgO、NaCl中只含有离子键,NaOH、Na2O2、NH4Cl中既含有离子键,又含有共价键。(5)共价化合物中只有共价键,一定没有离子键。(6)构成稀有气体的单质分子,由于原子已达到稳定结构,在这些原子的分子中不存在化学键。(7)非金属元素的原子之间也可以形成离子键,如NH4Cl等。(8)金属键只存在于金属单质或合金中。3.离子键、共价键与离子化合物、共价化合物的关系化学键的种类实例非金属单质无化学键稀有气体分子(单原子分子)He、Ne非极性共价键O===O、Cl—Cl、H—H(均为非极性分子)共价化合物只有共价键特例:AlCl3离子化合物只有离子键离子键、极性共价键离子键、非极性共价键离子键、极性共价键、配位键【典例2】下列叙述正确的是()A.两种非金属原子间不可能形成离子键B.非金属原子间不可能形成离子化合物C.离子化合物中不可能有共价键D.共价化合物中可能有离子键解析两种非金属原子间不能得失电子,不能形成离子键,A对;当非金属原子组成原子团时,可以形成离子化合物,如NH4Cl,B错;离子化合物中可以有共价键,如NaOH中的O—H键,C错;有离子键就是离子化合物,D错。答案A