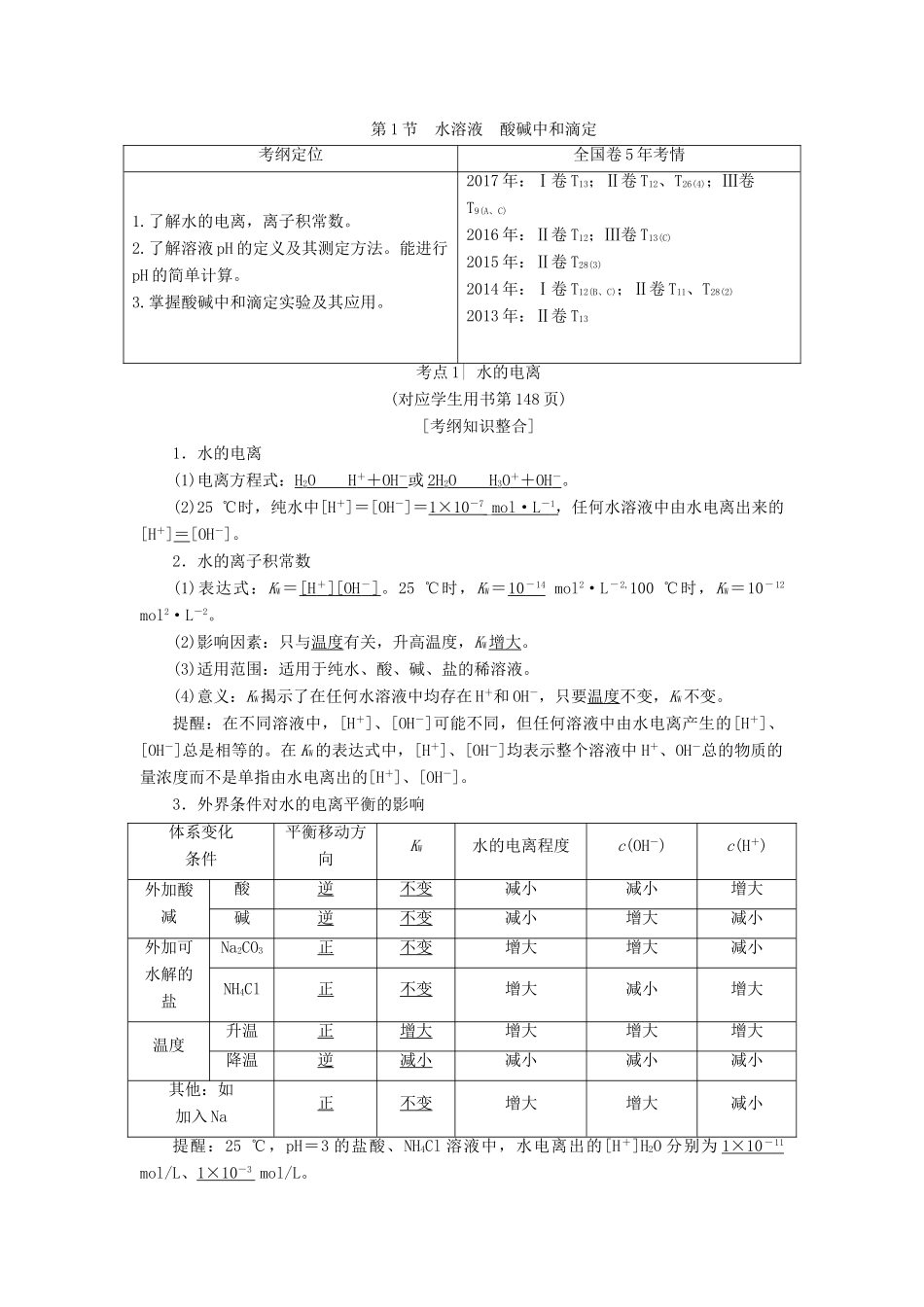
第1节水溶液酸碱中和滴定考纲定位全国卷5年考情1.了解水的电离,离子积常数。2.了解溶液pH的定义及其测定方法。能进行pH的简单计算。3.掌握酸碱中和滴定实验及其应用。2017年:Ⅰ卷T13;Ⅱ卷T12、T26(4);Ⅲ卷T9(A、C)2016年:Ⅱ卷T12;Ⅲ卷T13(C)2015年:Ⅱ卷T28(3)2014年:Ⅰ卷T12(B、C);Ⅱ卷T11、T28(2)2013年:Ⅱ卷T13考点1|水的电离(对应学生用书第148页)[考纲知识整合]1.水的电离(1)电离方程式:H2OH++OH-或2H2OH3O++OH-。(2)25℃时,纯水中[H+]=[OH-]=1×10-7_mol·L-1,任何水溶液中由水电离出来的[H+]=[OH-]。2.水的离子积常数(1)表达式:KW=[H+][OH-]。25℃时,KW=10-14mol2·L-2,100℃时,KW=10-12mol2·L-2。(2)影响因素:只与温度有关,升高温度,KW增大。(3)适用范围:适用于纯水、酸、碱、盐的稀溶液。(4)意义:KW揭示了在任何水溶液中均存在H+和OH-,只要温度不变,KW不变。提醒:在不同溶液中,[H+]、[OH-]可能不同,但任何溶液中由水电离产生的[H+]、[OH-]总是相等的。在KW的表达式中,[H+]、[OH-]均表示整个溶液中H+、OH-总的物质的量浓度而不是单指由水电离出的[H+]、[OH-]。3.外界条件对水的电离平衡的影响体系变化条件平衡移动方向KW水的电离程度c(OH-)c(H+)外加酸减酸逆不变减小减小增大碱逆不变减小增大减小外加可水解的盐Na2CO3正不变增大增大减小NH4Cl正不变增大减小增大温度升温正增大增大增大增大降温逆减小减小减小减小其他:如加入Na正不变增大增大减小提醒:25℃,pH=3的盐酸、NH4Cl溶液中,水电离出的[H+]H2O分别为1×10-11mol/L、1×10-3mol/L。[应用体验]判断正误(正确的打“√”,错误的打“×”)。(1)纯水中[H+]随温度升高而增大,酸性增强。()(2)酸、碱性溶液中水电离出的[H+]H2O=[OH-]H2O一定比纯水中的小。()(3)向水中加入酸式盐,溶液呈酸性,是因为促进了水的电离。()(4)25℃时,0.10mol·L-1NaHCO3溶液加水稀释后,[H+]与[OH-]的乘积变大。()(5)已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度始终增大。()(6)pH相同的两溶液中,水电离出的[H+]不一定相同。()【提示】(1)×(2)×(3)×(4)×(5)×(6)√[高考命题点突破]命题点1水的电离和KW的应用与计算1.25℃时,相同物质的量浓度的下列溶液:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是()A.④>③>②>①B.②>③>①>④C.④>①>②>③D.③>②>①>④C[②、③为碱、酸抑制水电离;④中NH水解促进水电离;①NaCl不影响水电离。]2.(2015·广东高考)一定温度下,水溶液中H+和OH-的浓度变化曲线如图所示。下列说法正确的是()A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10-13mol2·L-2C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化C[A.由图可知a、b、c三点对应的平衡常数不变,故a、b、c为等温线,升温,不能由c向b变化。B.由b点对应[H+]与[OH-]可知,KW=[H+][OH-]=1.0×10-7mol·L-1×1.0×10-7mol·L-1=1.0×10-14mol2·L-2。C.FeCl3溶液水解显酸性,溶液中[H+]增大,因一定温度下水的离子积是常数,故溶液中[OH-]减小,因此加入FeCl3溶液可能引起由b向a的变化。D.c点溶液呈碱性,稀释时[OH-]减小,同时[H+]应增大,故稀释溶液时不可能引起由c向d的变化。]3.(2018·韶关模拟)已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO。某温度下,向[H+]=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的[H+]=1×10-2mol·L-1。下列对该溶液的叙述不正确的是()A.该温度高于25℃B.由水电离出来的H+的浓度为1×10-10mol·L-1C.加入NaHSO4晶体抑制水的电离D.取该溶液加水稀释100倍,溶液中的水电离出的[H+]减小D[A项,KW=1×10-6mol·L-1×1×10-6mol·L-1=1×10-12mol2·L-2,温度高于25℃;B、C项,NaHSO4电离出的H+抑制H2O电离,[H+]H2O=[OH-]=1×10-...