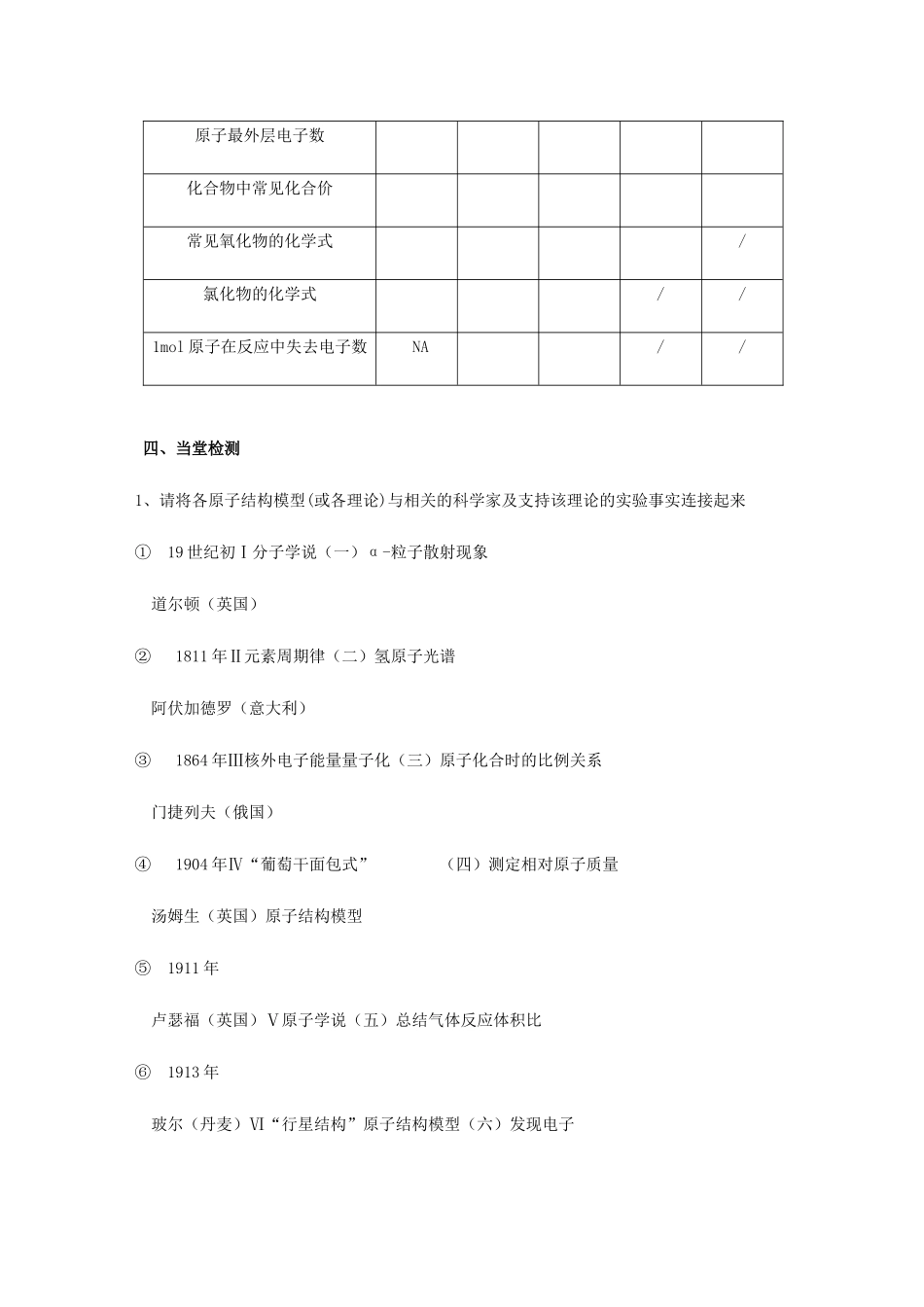
原子结构【学习目标】1、通过原子结构模型演变的学习,了解科学家探索原子结构的过程和化学学科发展趋势2、从原子核外电子的运动的角度初步认识镁和氧气发生反应的实质3、了解原子核外电子排布的【重点难点】重点:原子核外电子的运动特点及镁和氧气发生反应的实质难点:镁和氧气发生反应的实质【导学流程】一、基础感知1、举例说明构成物质的微粒种类有哪些?2、正误判断:(1)道尔顿是近代原子学说的创始人,他当时提出的原子论观点现在来看是有缺陷的。(2)原子由质子、中子、电子等基本粒子构成,质子和中子又由更小的粒子夸克构成。(3)汤姆生发现电子后,认为原子是由更小的微粒构成的,使人们认识到原子是可分的。(4)从原子结构模型的演变可知,每个新原子结构模型的建立都是以实验事实为依托的。(5)原子是化学变化中的最小微粒,故在化学变化过程中,原子不发生任何变化。(6)在多电子原子中,电子的能量不完全相同,它们在原子核外按能量不同分层排布。(7)在化学反应中,钠、镁等活泼金属原子容易得到电子形成稳定的电子层结构。(8)1molMg与足量O2充分反应后,将转移2mol电子。二、探究未知1、原子结构模型的演变2、原子核外电子的排布及与元素性质的关系(1)原子结构示意图(以钠为例,并标出结构中各部分的意义)(2)金属元素原子的最外层电子数一般小于,较易电子形成离子,在化合物中显化合价;非金属元素原子的最外层电子数一般大于或等于,较易电子,活泼非金属原子易形成离子,在化合物中主要显化合价;稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易或电子,通常表现为价。三、典型例题【典例1】提出原子结构模型的科学家,从时间的先后顺序来看,下列排列正确的是:A.汤姆生、玻尔、卢瑟福、道尔顿B.汤姆生、玻尔、道尔顿、卢瑟福C.卢瑟福、道尔顿、汤姆生、玻尔D.道尔顿、汤姆生、卢瑟福、玻尔【典例2】按要求填表:钠镁铝硫氧原子结构示意图原子最外层电子数化合物中常见化合价常见氧化物的化学式/氯化物的化学式//1mol原子在反应中失去电子数NA//四、当堂检测1、请将各原子结构模型(或各理论)与相关的科学家及支持该理论的实验事实连接起来①19世纪初Ⅰ分子学说(一)α-粒子散射现象道尔顿(英国)②1811年Ⅱ元素周期律(二)氢原子光谱阿伏加德罗(意大利)③1864年Ⅲ核外电子能量量子化(三)原子化合时的比例关系门捷列夫(俄国)④1904年Ⅳ“葡萄干面包式”(四)测定相对原子质量汤姆生(英国)原子结构模型⑤1911年卢瑟福(英国)Ⅴ原子学说(五)总结气体反应体积比⑥1913年玻尔(丹麦)Ⅵ“行星结构”原子结构模型(六)发现电子2、下图为几种粒子的结构示意图,完成以下填空。(1)写出①代表的微粒的化学式。(2)写出⑦的氧化物的化学式。(3)属于阳离子结构的粒子是(填编号,下同)。(4)具有稳定性结构的原子是。(5)在化学反应中容易失去电子的粒子是。(6)某元素R形成的氧化物为R2O3,则R的离子结构示意图可能是。