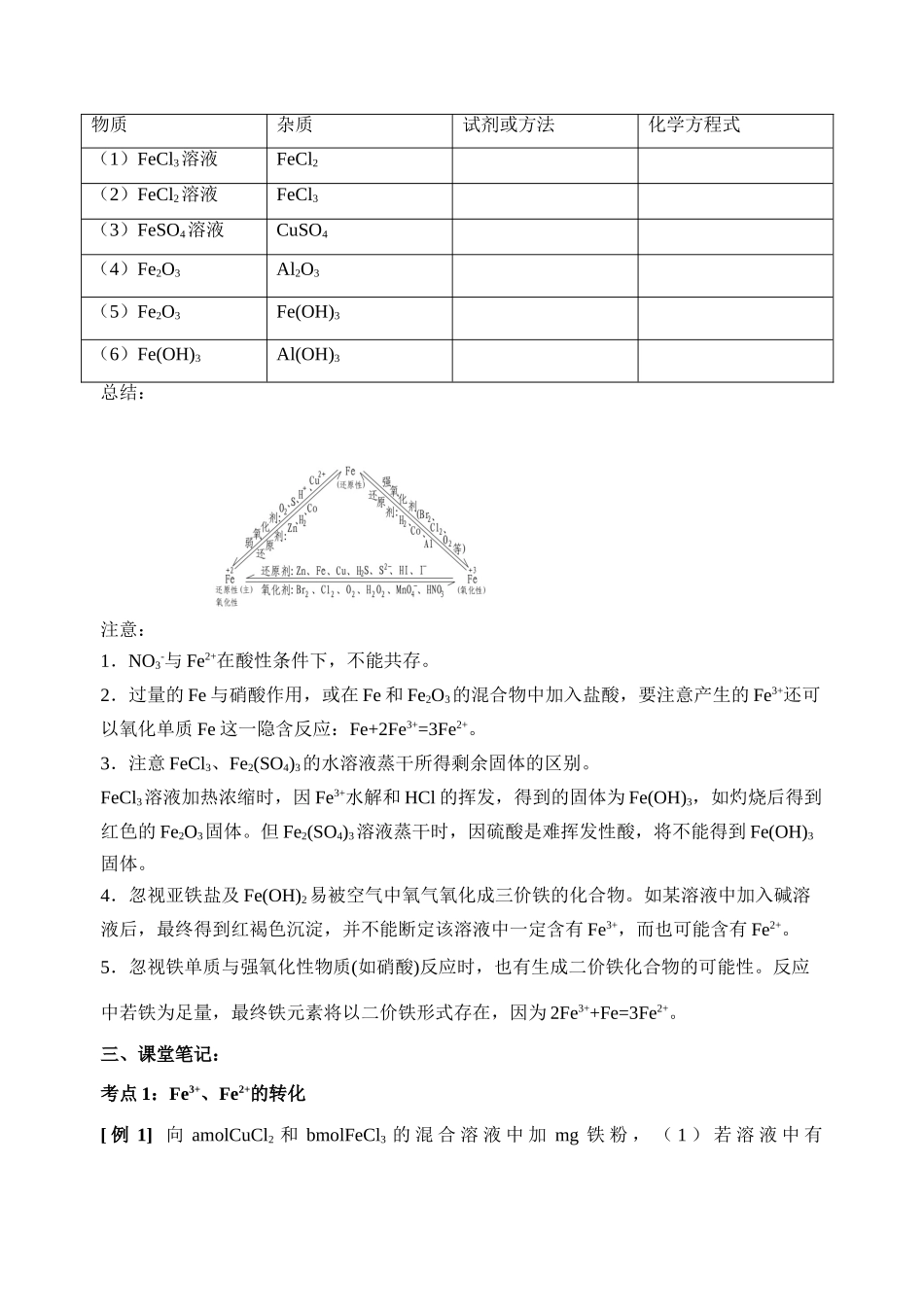
高三化学学科一体化教学案编写人景均编号27课时课时27—铁、铜的获取及应用.专题三从矿物到基础材料一、考纲要求:1.掌握Fe2+、Fe3+的相互转化关系2.掌握Fe2+、Fe3+的有关计算、除杂、鉴别、分离等方面的应用。3.重点掌握根据氧化还原的原理进行有关铁及其化合物的相关计算。培养分析、综合、归纳问题的能力和解决问题的能力。二、知识结构:Fe3+、Fe2+的性质和相互转化关系1.Fe3+与Fe2+的相互转化:FeCl2+Cl2=______________________FeCl2+Br2=______________________Fe(OH)2+H2O+=Fe(OH)3FeCl3+Cu=________________FeCl3+Fe=______________________FeCl3+H2S=______________FeCl3+SO2+H2O=_________________FeCl3+Na2S(少量)=______________FeCl3+Na2S(过量)=______________2.Fe3+与Fe2+的鉴别:①观察法:其溶液呈色者是Fe3+,呈色者是Fe2+H②2S法:通入H2S气体或加入氢硫酸,有色沉淀析出者是,无明显变化的是。KSCN③法:加入可溶性硫氰化物溶液,呈色者是,无明显变化的是。离子方程式为:④苯酚法:加入苯酚溶液,呈色者是,无明显变化的是。⑤碱液法:分别通入氨气或加入氨水或碱液,生成色沉淀者是;生成沉淀,并变为色,最终变成色者是。⑥淀粉KI试纸法:能使淀粉KI试纸变蓝者,无明显变化的是。离子方程式为:⑦铜片法:分别加入铜片,铜片且溶液变为色的是,无明显变化的是。KMnO⑧4法:分别加入少量酸性KMnO4溶液,能使KMnO4溶液的色变浅的是,颜色基本无变化的是。离子方程式为:3.下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法将杂质除去:物质杂质试剂或方法化学方程式(1)FeCl3溶液FeCl2(2)FeCl2溶液FeCl3(3)FeSO4溶液CuSO4(4)Fe2O3Al2O3(5)Fe2O3Fe(OH)3(6)Fe(OH)3Al(OH)3总结:注意:1.NO3-与Fe2+在酸性条件下,不能共存。2.过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+=3Fe2+。3.注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别。FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体。但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体。4.忽视亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+。5.忽视铁单质与强氧化性物质(如硝酸)反应时,也有生成二价铁化合物的可能性。反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+。三、课堂笔记:考点1:Fe3+、Fe2+的转化[例1]向amolCuCl2和bmolFeCl3的混合溶液中加mg铁粉,(1)若溶液中有Fe3+、Fe2+、Cu2+,则m和a、b的关系为,(2)若溶液中仅有Fe2+和Cu2+,则m和a、b的关系为,(3)若溶液中只有Fe2+,则m和a、b的关系为,[感悟]:考点2:Fe3+、Fe2+的检验[例2]老师在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡,溶液变为浅黄色。(1)甲学生认为这不是发生化学反应所致,使溶液变黄的物质是,乙学生认为这是化学反应所致,使溶液变黄的是。(2)老师提供如下试剂:A、酸性高锰酸钾溶液B、四氯化碳C、碘化钾溶液D、硫氰化钾溶液请你验证,乙同学的推断是正确的,你选择的试剂是(填编号),实验中观察到的现象是。(3)根据上述实验的事实推测,若在溴化亚铁溶液中通入氯气,先后发生的反应分别是(用离子方程式表示)。[感悟]:四、疑难问题:1.2.五、作业练习:1.久置于空气中的下列物质,因被氧化而呈黄色的是()A.浓HNO3B.氯化亚铁溶液C.溴苯D.溴化银2.实验室中为了妥善保存硫酸亚铁溶液常加入少量的()A.镁粉B.锌粒C.铁片D.铜片3.要除去FeCl2溶液中的少量FeCl3,可行的办法是()A.滴入KSCN溶液B.通入氯气C.加入铜粉D.加入铁粉4.苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有()A.氧化性B.还原性C.碱性D.酸性5.能与大量Fe3+共存的是()A.FeB.S2-C.Cu...