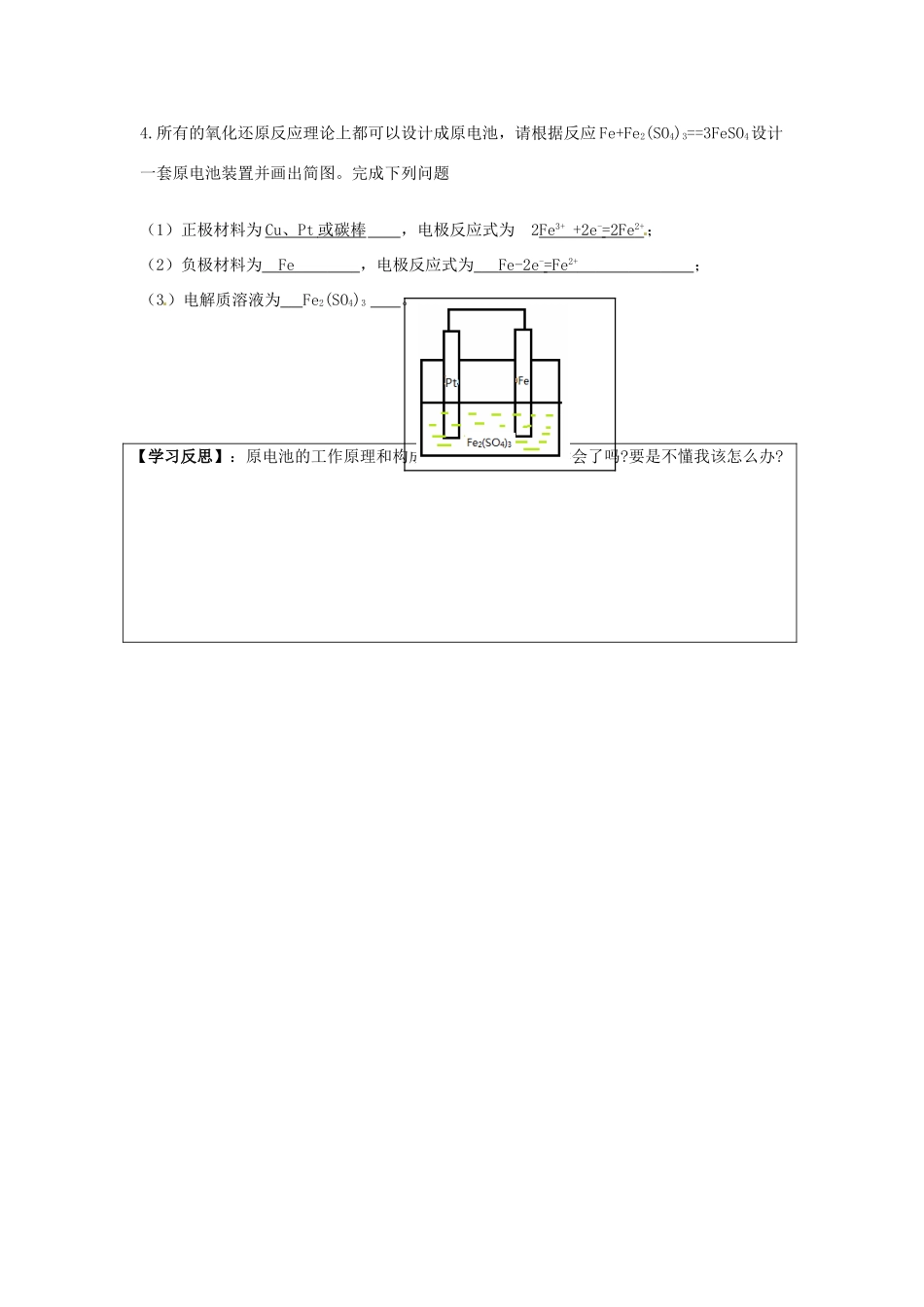
第二章化学反应与能量第二节化学能与电能(第1课时)【教学目标】1.了解化学能与电能的转化过程2.了解原电池构造,掌握原电池原理【自主学习】:任务一.化学能转化为电能1、一次能源和二次能源(阅读教材39页资料卡片)风能、天然气、蒸汽、流水中属于二次能源的是:风能2、化学能与电能的相互转化火力发电工作原理(阅读教材40页):火力发电的能量转换过程:化学能(热能)(机械能)电能3.为什么说氧化还原反应是化学能转变为电能的关键?因为氧化还原反应中有电子的转移,而电子的定向移动可以形成电流,【合作探究】(阅读教材40页到41页及小组实验探究分析)Cu-Zn原电池原理实验:⑴以Cu-Zn原电池为例,分析原电池的工作原理(如下图):ABCD①在A图中标出正负极;②在B图中标出电子的移动方向;③在C图中标出H+的移动方向,④在D图中标出SO42-的移动方向。(2)以Cu-Zn原电池(电解液为稀硫酸)为例电极电极材料电极反应反应类型负极ZnZn-2e-=Zn2+氧化反应燃烧烧)(蒸汽汽)(发电机机)正极Cu2H++2e-=H2↑还原反应(3)1、原电池概念:将化学能转化为电能的装置。2、原电池原理:较活泼的金属失电子,发生氧化反应,电子从负极通过外电路流向正极,溶液中氧化性较强的离子在正极得电子被还原。(4)阅读教材41页,科学探究,画出你设计的装置图,知道这套电池装置的原理吗?(5)化学电池由哪几部分构成?(原电池的形成条件)①有活动性不同的两个电极②有电解质溶液③导线相连形成闭合回路④.能自发进行氧化还原反应。【目标检测】(A级:全体学生都要做)1、下列各组金属和溶液,能组成原电池的是BDACu、Cu、稀硫酸BZn、Cu、稀硫酸CCu、Zn、蔗糖溶液DZn、Cu、CuSO4溶液2、根据右边的原电池装置,完成下列问题:写出正负极的电极反应负极:Cu-2e-=Cu2+正极:2Ag++2e-=2Ag标出电子的流动方向,Pt片的质量是增加还是减少?为什么?质量增加,是因为银离子在正极得电子析出银3、在如图所示的8个装置中,属于原电池的是DA.①④B.③④⑤C.④⑧D.②④⑥⑦(B级:实验班学生必须做,普通班学生选做)4.所有的氧化还原反应理论上都可以设计成原电池,请根据反应Fe+Fe2(SO4)3==3FeSO4设计一套原电池装置并画出简图。完成下列问题(1)正极材料为Cu、Pt或碳棒,电极反应式为2Fe3++2e-=2Fe2+;(2)负极材料为Fe,电极反应式为Fe-2e-=Fe2+;(3)电解质溶液为Fe2(SO4)3。【学习反思】:原电池的工作原理和构成条件(几要素?),我学会了吗?要是不懂我该怎么办?