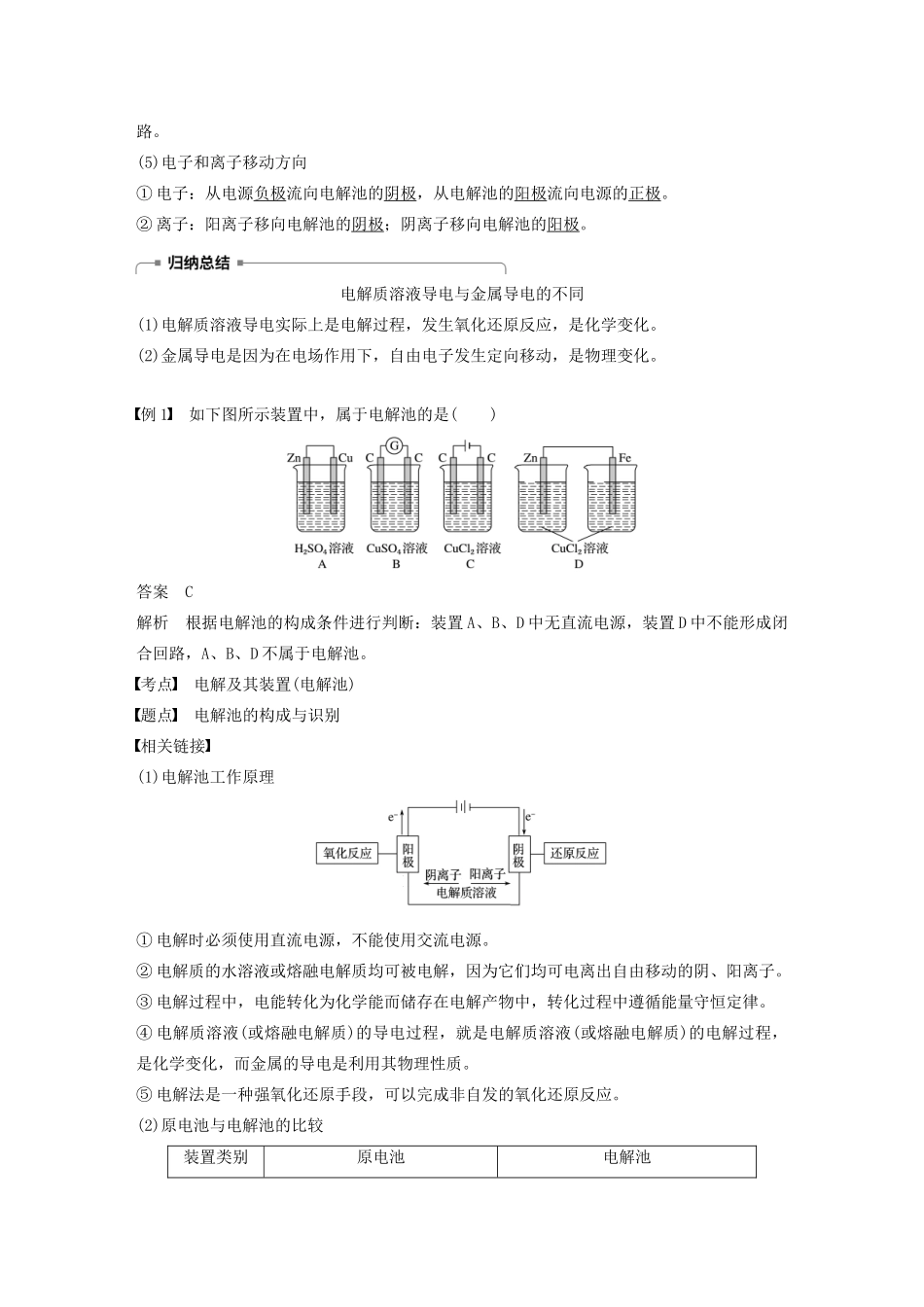
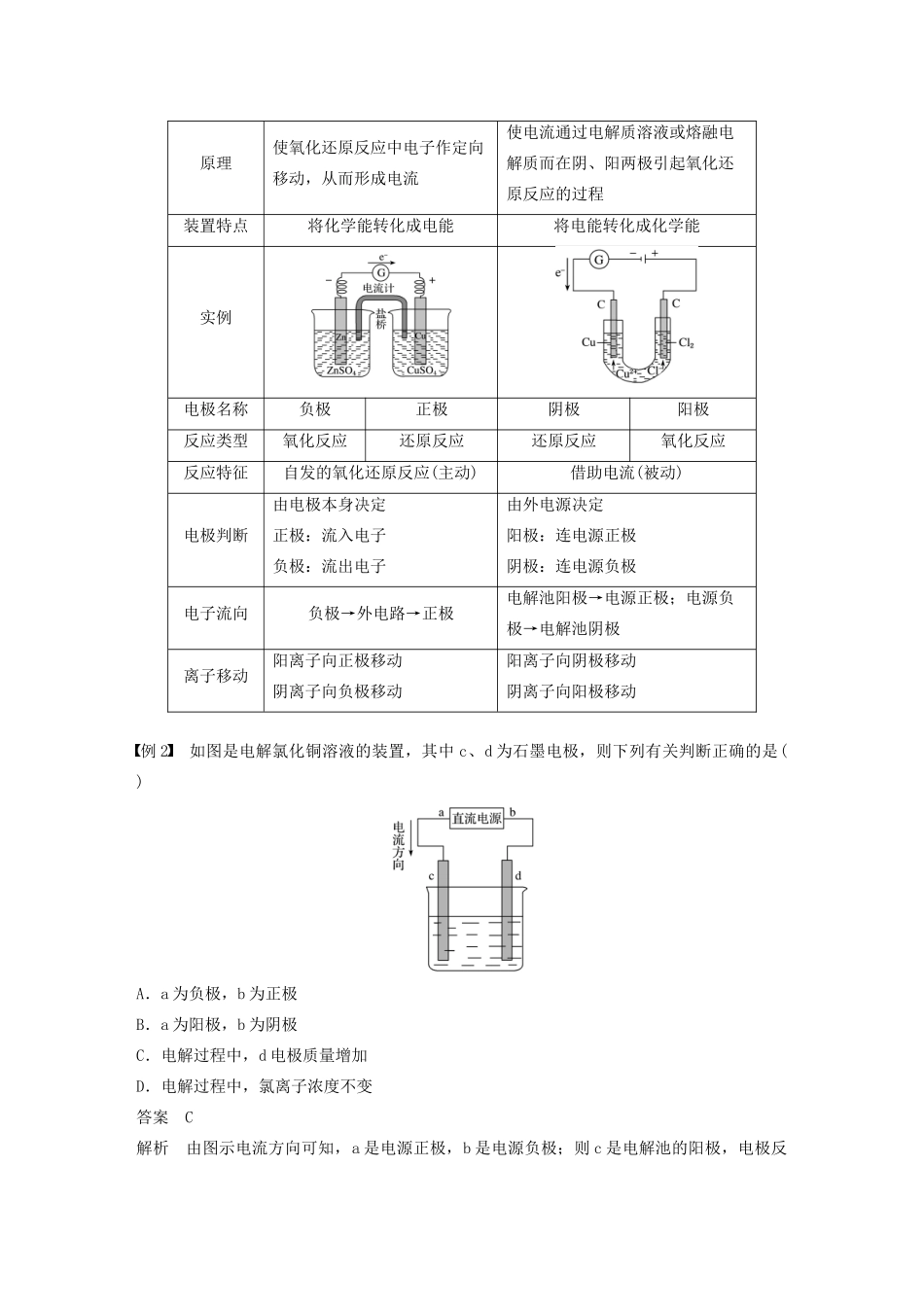
电解池的工作原理[核心素养发展目标]1.宏观辨识与微观探析:从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其变化、电流形成的过程和原理。2.证据推理与模型认知:建立对电解过程的系统分析认识的思维模型,理解电解的规律,会判断电解的产物,会书写电解的电极反应式和总反应式。一、电解原理1.电解氯化铜溶液实验探究(1)按下图所示装置完成实验,并填写下表。实验现象实验结论电流计指针发生偏转说明电解质溶液导电,形成闭合回路与负极相连的b极上逐渐覆盖了一层红色物质析出金属铜与正极相连的a极上有刺激性气味的气体产生,能使湿润的碘化钾淀粉试纸变蓝产生了氯气(2)实验原理分析①氯化铜溶液中存在的离子有Cu2+、Cl-、H+、OH-,通电前这些离子在溶液中作自由运动。②通电时在电场的作用下,溶液中的离子作定向运动,即Cl-、OH-趋向a极,Cu2+、H+趋向b极。③a极电极反应式是2Cl--2e-===Cl2↑,b极电极反应式是Cu2++2e-===Cu,总反应式是CuCl2=====Cu+Cl2↑。④结论:电解质溶液的导电过程,就是电解质溶液的电解过程。2.电解和电解池(1)电解:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程。(2)电解池:将电能转化为化学能的装置。(3)电解池的电极名称阴极:与电源负极相连的电极,发生还原反应;阳极:与电源正极相连的电极,发生氧化反应。(4)电解池的构成条件:①具有直流电源;②两个电极(阴极、阳极);③电解质溶液或熔融电解质;④形成闭合回路。(5)电子和离子移动方向①电子:从电源负极流向电解池的阴极,从电解池的阳极流向电源的正极。②离子:阳离子移向电解池的阴极;阴离子移向电解池的阳极。电解质溶液导电与金属导电的不同(1)电解质溶液导电实际上是电解过程,发生氧化还原反应,是化学变化。(2)金属导电是因为在电场作用下,自由电子发生定向移动,是物理变化。例1如下图所示装置中,属于电解池的是()答案C解析根据电解池的构成条件进行判断:装置A、B、D中无直流电源,装置D中不能形成闭合回路,A、B、D不属于电解池。考点电解及其装置(电解池)题点电解池的构成与识别相关链接(1)电解池工作原理①电解时必须使用直流电源,不能使用交流电源。②电解质的水溶液或熔融电解质均可被电解,因为它们均可电离出自由移动的阴、阳离子。③电解过程中,电能转化为化学能而储存在电解产物中,转化过程中遵循能量守恒定律。④电解质溶液(或熔融电解质)的导电过程,就是电解质溶液(或熔融电解质)的电解过程,是化学变化,而金属的导电是利用其物理性质。⑤电解法是一种强氧化还原手段,可以完成非自发的氧化还原反应。(2)原电池与电解池的比较装置类别原电池电解池原理使氧化还原反应中电子作定向移动,从而形成电流使电流通过电解质溶液或熔融电解质而在阴、阳两极引起氧化还原反应的过程装置特点将化学能转化成电能将电能转化成化学能实例电极名称负极正极阴极阳极反应类型氧化反应还原反应还原反应氧化反应反应特征自发的氧化还原反应(主动)借助电流(被动)电极判断由电极本身决定正极:流入电子负极:流出电子由外电源决定阳极:连电源正极阴极:连电源负极电子流向负极→外电路→正极电解池阳极→电源正极;电源负极→电解池阴极离子移动阳离子向正极移动阴离子向负极移动阳离子向阴极移动阴离子向阳极移动例2如图是电解氯化铜溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是()A.a为负极,b为正极B.a为阳极,b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变答案C解析由图示电流方向可知,a是电源正极,b是电源负极;则c是电解池的阳极,电极反应为2Cl--2e-===Cl2↑,溶液中氯离子不断减少;d是电解池的阴极,电极反应为Cu2++2e-===Cu,d电极质量不断增加。考点电解及其装置(电解池)题点电解池的电极判断方法点拨——电解池阴极和阳极的判断依据相关链接电解池中电极名称判断的几种方法(1)根据外接电源的正、负极判断:电源正极连接的是阳极,电源负极连接的是阴极。(2)根据电极质量变化判断:如果电极质量减轻,该电极一定是阳极;如果质量增加,该电极一...