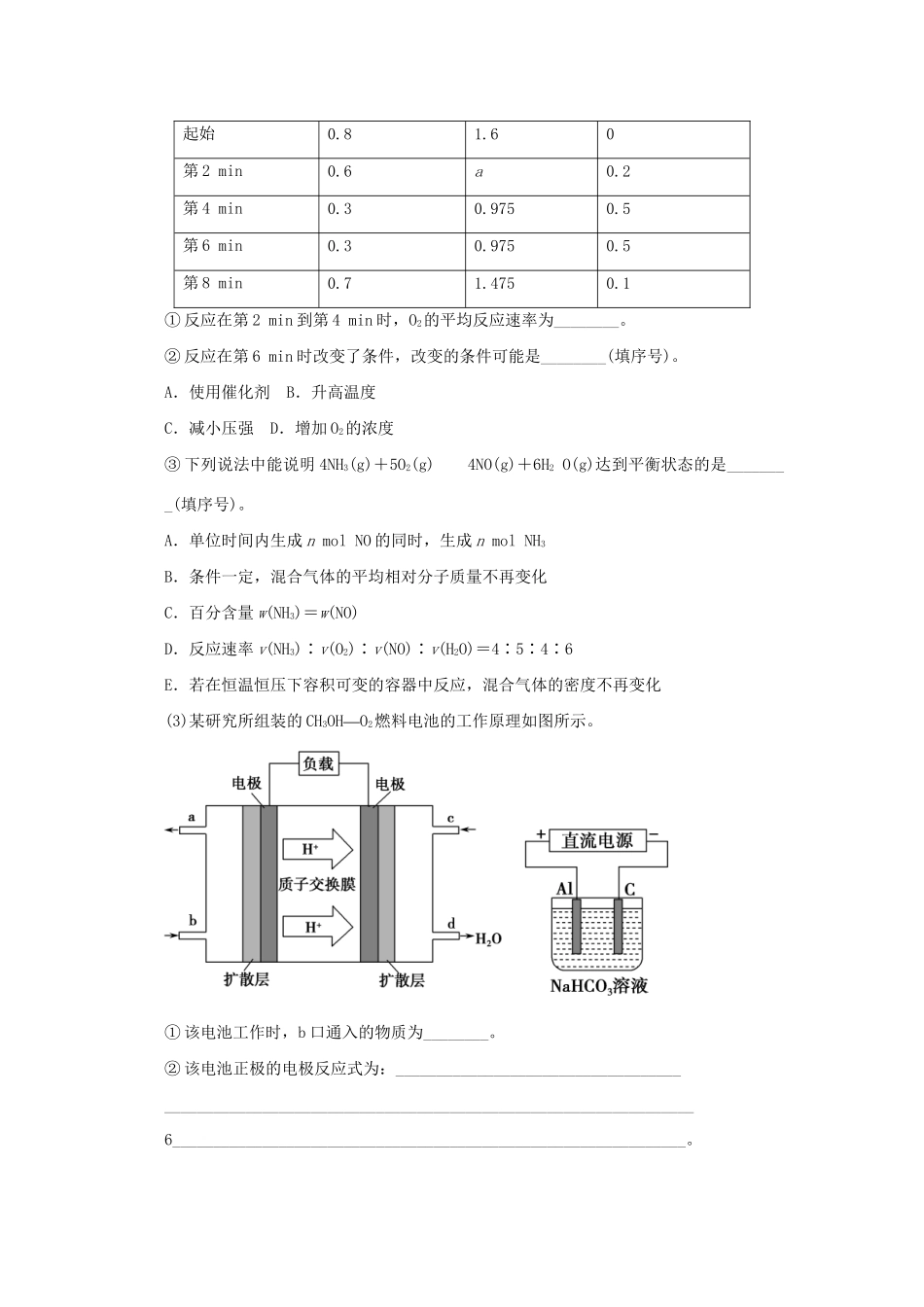
滚动加练2化学基本理论综合应用1.(·烟台5月适应测试)合成氨技术的发明使工业化人工固氮成为现实。(1)已知N2(g)+3H2(g)2NH3(g)ΔH=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为________。(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如图所示。由图可知:①温度T1、T2时的平衡常数分别为K1、K2,则K1________K2(“”“”填>或<)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡________移动(“”“”“”填向左、向右或不)。②T2温度时,在1L的密闭容器中加入2.1molN2、1.5molH2,经10min达到平衡,则v(H2)=________。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡________移动(“”“”“”填向左、向右或不)。(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)H2O(l)+CO(NH2)2(l)ΔH1在一定压强下测得如下数据:温度/℃CO2转化率%n(NH3)/n(CO2)100150200119.627.136.61.5abc2def①则该反应ΔH________0,表中数据a________d,b________f(“”“”均选填>、=或“”<)。②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理________________________________________________________________________。解析(1)由题意知,生成2molNH3放出的热量为92.2kJ,所以放出的热量为:92.2kJ·mol-1÷2×=69.15kJ。(2)①由图像知,随温度的升高,NH3%减小,平衡向逆向移动,所以K1>K2;恒温恒压的条件下,向平衡体系中通入氦气,容器体积增大,平衡向左移动。②设T2温度时H2转化的物质的量浓度为xmol·L-1N2(g)+3H2(g)2NH3(g)ΔH=-92.2kJ·mol-12.11.50xx2.1-1.5-xx所以=20%x=0.9mol·L-1v(H2)=0.9mol·L-1÷10min=0.09mol·L-1·min-1T2温度时的平衡常数:K===L2·mol-2,平衡后,再向该容器内通入N2、H2、NH3各0.4mol,则有:Qc===L2·mol-2<L2·mol-2,所以,平衡向右移动。(3)①由图表中的数据知:随温度升高,CO2的转化率增大,平衡向右移动,正反应方向吸热,ΔH>0和c>b>a,f>e>d,由增大一种反应物的浓度而另一种反应物转化率增大知:d>a,则f>b。②从尿素合成塔内出来的气体中仍有一定量的CO2、NH3,应分离后再利用。答案(1)69.15kJ(2)①>向左②0.09mol·L-1·min-1向右(3)①><<②净化后重新充入合成塔内,循环利用,提高原料利用率2.(·宁波十校联考)工业制硝酸的主要反应为:4NH3(g)+5O2(g)===4NO(g)+6H2O(g)ΔH。(1)已知氢气的燃烧热为285.8kJ·mol-1;N2(g)+3H2(g)===2NH3(g)ΔH=-92.4kJ·mol-1;H2O(l)===H2O(g)ΔH=+44.0kJ·mol-1;N2(g)+O2(g)===2NO(g)ΔH=+180.6kJ·mol-1。则上述工业制硝酸的主要反应的ΔH=________。(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:浓度时间c(NH3)/mol·L-1c(O2)/mol·L-1c(NO)/mol·L-1起始0.81.60第2min0.6a0.2第4min0.30.9750.5第6min0.30.9750.5第8min0.71.4750.1①反应在第2min到第4min时,O2的平均反应速率为________。②反应在第6min时改变了条件,改变的条件可能是________(填序号)。A.使用催化剂B.升高温度C.减小压强D.增加O2的浓度③下列说法中能说明4NH3(g)+5O2(g)4NO(g)+6H2O(g)达到平衡状态的是________(填序号)。A.单位时间内生成nmolNO的同时,生成nmolNH3B.条件一定,混合气体的平均相对分子质量不再变化C.百分含量w(NH3)=w(NO)D.反应速率v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化(3)某研究所组装的CH3OH—O2燃料电池的工作原理如图所示。①该电池工作时,b口通入的物质为________。②该电池正极的电极反应式为:____________________________________________________________________________________________________6_______________________________________________________________。③以此电池作电源,“”在实验室中模拟铝制品表面钝化处理(装置如下图所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是_______...