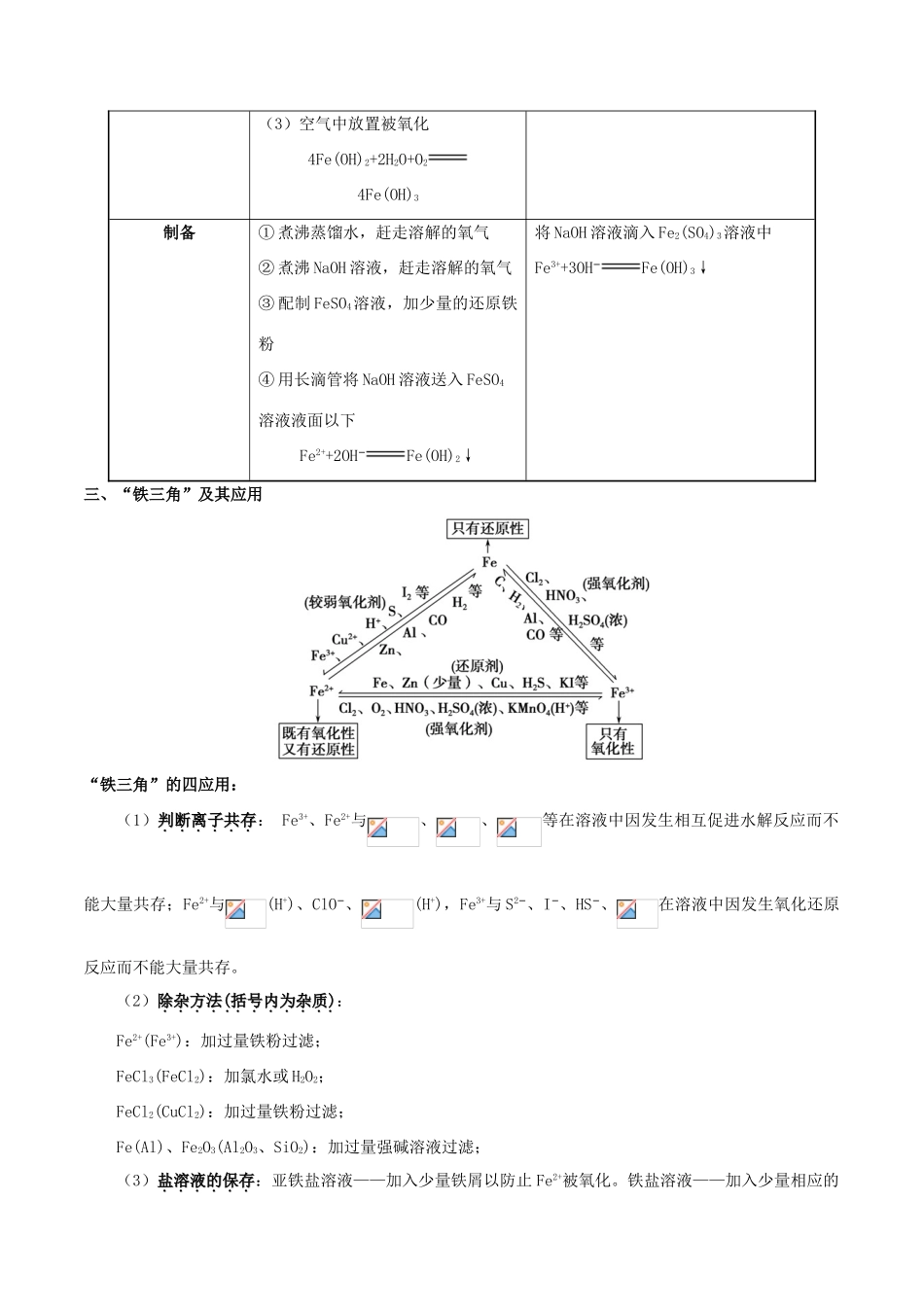
专题16铁及其重要化合物一、铁的性质1.铁的物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。2.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。(1)与非金属单质的反应:①与O2的反应:常温下:铁被腐蚀生成铁锈,其主要成分为Fe2O3。点燃时:3Fe+2O2=====Fe3O4。②与Cl2的反应:2Fe+3Cl2=====2FeCl3。③与S的反应:Fe+S=====FeS。(2)与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe+4H2O(g)=====Fe3O4+4H2。(3)与酸的反应:①与非氧化性酸反应的离子方程式:Fe+2H+===Fe2++H2↑。②与氧化性酸:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H2产生。Fe过量3Fe+8H++23Fe2++2NO↑+4H2OFe不足Fe+4H++Fe3++NO↑+2H2O(4)与某些盐溶液的反应:①与CuSO4溶液反应的离子方程式:Fe+Cu2+===Fe2++Cu。②与FeCl3溶液反应的离子方程式:2Fe3++Fe===3Fe2+。二、铁的氧化物和氢氧化物1.铁的氧化物的比较铁的氧化物FeOFe2O3Fe3O4俗称无铁红磁性氧化铁色、态黑色粉末红棕色粉末黑色晶体铁的价态+2+3+2、+3水溶性难溶于水稳定性不稳定性6FeO+O22Fe3O4稳定稳定与非氧化性酸的反应FeO+2H+Fe2++H2OFe2O3+6H+2Fe3++3H2OFe3O4+8H+2Fe3++Fe2++4H2O与CO的反应FexOy+yCOxFe+yCO2制取高温熔融,过量的铁与氧气反应2Fe+O22FeOFe(OH)3的分解2Fe(OH)3Fe2O3+3H2O铁在氧气中燃烧3Fe+2O2Fe3O42.铁的氢氧化物的比较铁的氢氧化物Fe(OH)2Fe(OH)3物理性质白色,难溶于水的固体红褐色,难溶于水的固体化学性质(1)与非氧化性强酸反应Fe(OH)2+2H+Fe2++2H2O(2)与氧化性酸反应3Fe(OH)2+10HNO33Fe(NO3)3+NO↑+8H2O(1)与酸反应Fe(OH)3+3H+Fe3++3H2O(2)受热分解2Fe(OH)3Fe2O3+3H2O(3)空气中放置被氧化4Fe(OH)2+2H2O+O24Fe(OH)3制备①煮沸蒸馏水,赶走溶解的氧气②煮沸NaOH溶液,赶走溶解的氧气③配制FeSO4溶液,加少量的还原铁粉④用长滴管将NaOH溶液送入FeSO4溶液液面以下Fe2++2OH−Fe(OH)2↓将NaOH溶液滴入Fe2(SO4)3溶液中Fe3++3OH−Fe(OH)3↓三、“铁三角”及其应用“铁三角”的四应用:(1)判断离子共存判断离子共存:Fe3+、Fe2+与、、等在溶液中因发生相互促进水解反应而不能大量共存;Fe2+与(H+)、ClO−、(H+),Fe3+与S2−、I−、HS−、在溶液中因发生氧化还原反应而不能大量共存。(2)除杂方法除杂方法((括号内为杂质括号内为杂质)):Fe2+(Fe3+):加过量铁粉过滤;FeCl3(FeCl2):加氯水或H2O2;FeCl2(CuCl2):加过量铁粉过滤;Fe(Al)、Fe2O3(Al2O3、SiO2):加过量强碱溶液过滤;(3)盐溶液的保存盐溶液的保存:亚铁盐溶液——加入少量铁屑以防止Fe2+被氧化。铁盐溶液——加入少量相应的酸溶液以防止Fe3+水解。(4)物质制备物质制备:①制备无水氯化铁:在HCl气流中加热浓缩氯化铁溶液;②制备氢氧化铁胶体:向沸水中加入饱和氯化铁溶液并煮沸至变为红褐色为止。四、重要的铁盐三氯化铁(FeCl3):棕黄色固体,一种常见的氧化剂,能与多种还原剂发生氧化还原反应,能回收废铜,其反应的离子方程式为2Fe3++CuCu2++2Fe2+。绿矾(FeSO4·7H2O):一种重要的还原剂,可用作补血剂及植物的补铁剂。高铁酸钾(K2FeO4):深紫色晶体,具有强氧化性,可用作水处理剂或高能电池。铁铵矾[NH4Fe(SO4)2·12H2O]:无色晶体,易溶于水,常用作化学分析试剂、药物和织物媒染剂。赤血盐[K3Fe(CN)6]:红色晶体,易溶于水,常用于检验Fe2+,生成蓝色沉淀。考向一Fe2+、Fe3+的鉴别(1)直接观察颜色:Fe2+溶液呈浅绿色,Fe3+溶液呈棕黄色。(2)利用显色反应(形成络离子)①②(3)利用Fe(OH)3沉淀的颜色:(4)利用Fe3+的氧化性①②③(5)利用Fe2+的还原性①②(6)利用铁氰化钾与亚铁离子反应生成蓝色的铁氰化亚铁沉淀检验亚铁离子。典例1向某无色溶液中加入含Fe2+的溶液无明显变化,当滴加几滴稀H2SO4后,混合液出现红色,下列结论中错误的是A.Fe2+被H2SO4氧化成Fe3+B.原无色溶液中一定含有SCN−C.Fe2+与SCN−不能形成红色化合物D.将...