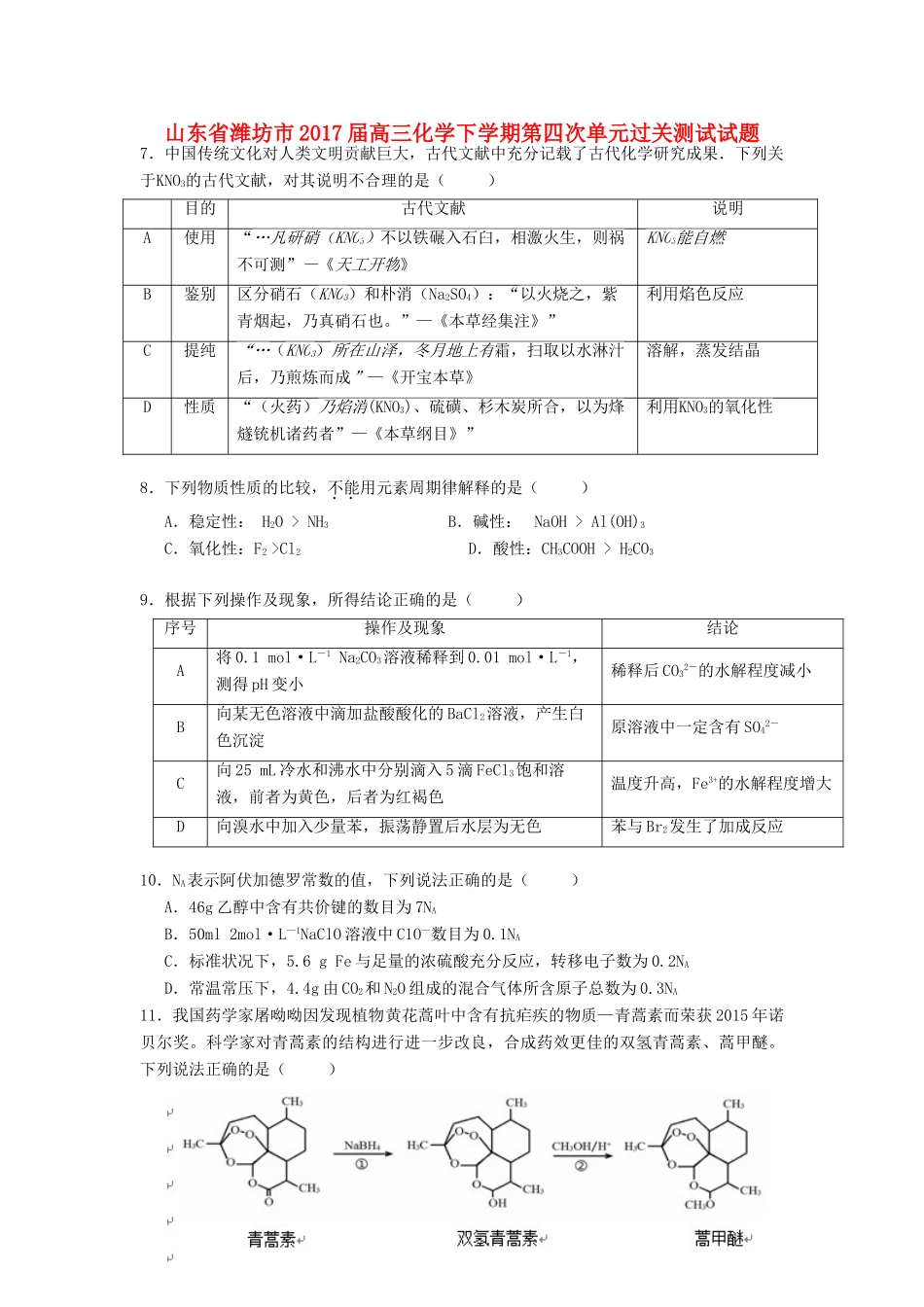
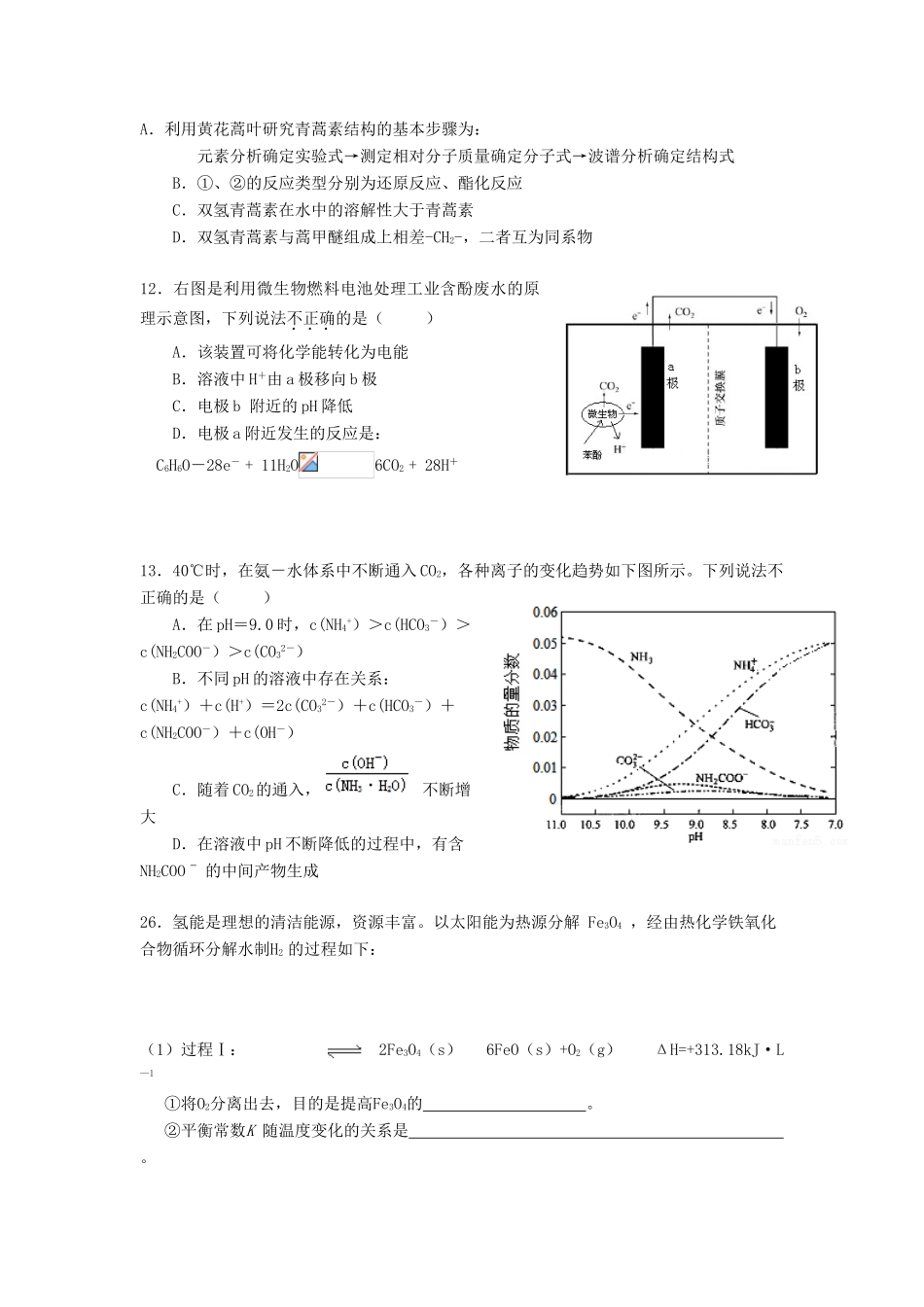
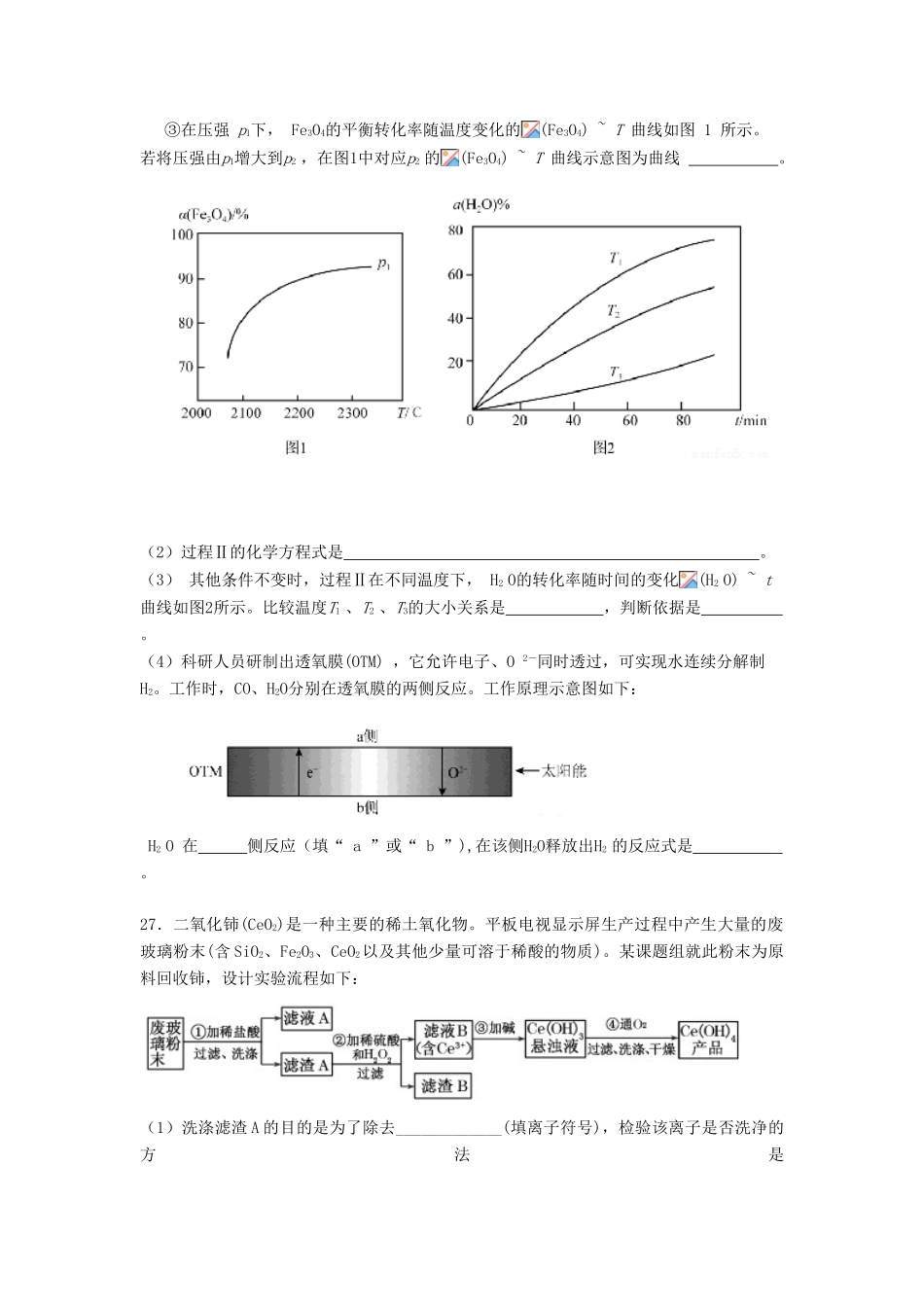
山东省潍坊市2017届高三化学下学期第四次单元过关测试试题7.中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果.下列关于KNO3的古代文献,对其说明不合理的是()目的古代文献说明A使用“…凡研硝(KNO3)不以铁碾入石臼,相激火生,则祸不可测”—《天工开物》KNO3能自燃B鉴别区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也。”—《本草经集注》”利用焰色反应C提纯“…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”—《开宝本草》溶解,蒸发结晶D性质“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”—《本草纲目》”利用KNO3的氧化性8.下列物质性质的比较,不能用元素周期律解释的是()A.稳定性:H2O>NH3B.碱性:NaOH>Al(OH)3C.氧化性:F2>Cl2D.酸性:CH3COOH>H2CO39.根据下列操作及现象,所得结论正确的是()序号操作及现象结论A将0.1mol·L-1Na2CO3溶液稀释到0.01mol·L-1,测得pH变小稀释后CO32-的水解程度减小B向某无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀原溶液中一定含有SO42-C向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色温度升高,Fe3+的水解程度增大D向溴水中加入少量苯,振荡静置后水层为无色苯与Br2发生了加成反应10.NA表示阿伏加德罗常数的值,下列说法正确的是()A.46g乙醇中含有共价键的数目为7NAB.50ml2mol·L—1NaClO溶液中C1O—数目为0.1NAC.标准状况下,5.6gFe与足量的浓硫酸充分反应,转移电子数为0.2NAD.常温常压下,4.4g由CO2和N2O组成的混合气体所含原子总数为0.3NA11.我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质—青蒿素而荣获2015年诺贝尔奖。科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚。下列说法正确的是()A.利用黄花蒿叶研究青蒿素结构的基本步骤为:元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式B.①、②的反应类型分别为还原反应、酯化反应C.双氢青蒿素在水中的溶解性大于青蒿素D.双氢青蒿素与蒿甲醚组成上相差-CH2-,二者互为同系物12.右图是利用微生物燃料电池处理工业含酚废水的原理示意图,下列说法不正确的是()A.该装置可将化学能转化为电能B.溶液中H+由a极移向b极C.电极b附近的pH降低D.电极a附近发生的反应是:C6H6O-28e-+11H2O6CO2+28H+13.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是()A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)C.随着CO2的通入,不断增大D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成26.氢能是理想的清洁能源,资源丰富。以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下:(1)过程Ⅰ:2Fe3O4(s)6FeO(s)+O2(g)ΔH=+313.18kJ·L—1①将O2分离出去,目的是提高Fe3O4的。②平衡常数K随温度变化的关系是。③在压强p1下,Fe3O4的平衡转化率随温度变化的(Fe3O4)~T曲线如图1所示。若将压强由p1增大到p2,在图1中对应p2的(Fe3O4)~T曲线示意图为曲线。(2)过程Ⅱ的化学方程式是。(3)其他条件不变时,过程Ⅱ在不同温度下,H2O的转化率随时间的变化(H2O)~t曲线如图2所示。比较温度T1、T2、T3的大小关系是,判断依据是。(4)科研人员研制出透氧膜(OTM),它允许电子、O2-同时透过,可实现水连续分解制H2。工作时,CO、H2O分别在透氧膜的两侧反应。工作原理示意图如下:H2O在侧反应(填“a”或“b”),在该侧H2O释放出H2的反应式是。27.二氧化铈(CeO2)是一种主要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组就此粉末为原料回收铈,设计实验流程如下:(1)洗涤滤渣A的目的是为了除去_____________(填离子符号),检验该离子是否洗净的方法是。(2)第②步反应的离子方程式是,滤渣B的主要成分是。(3)萃取...