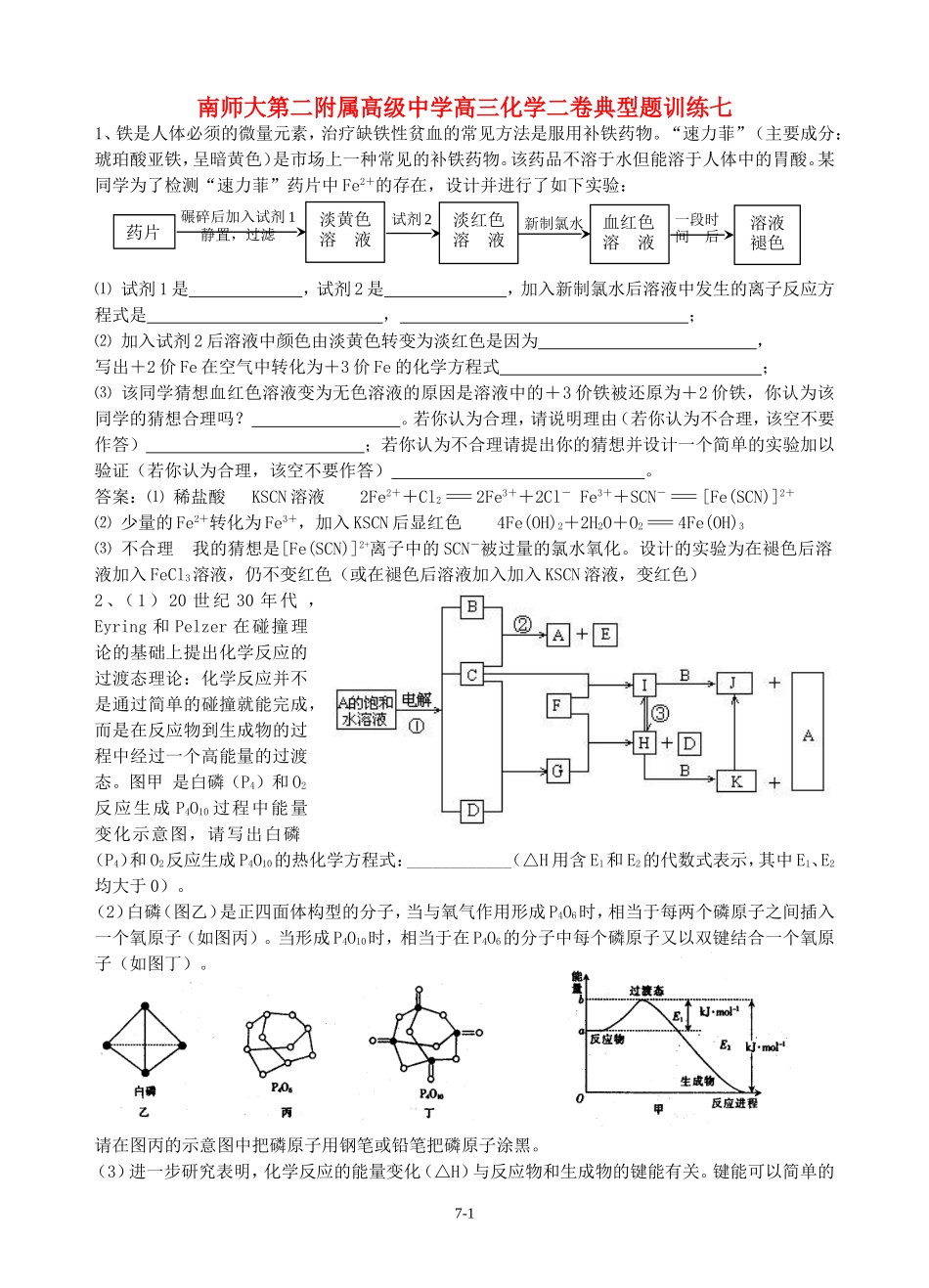
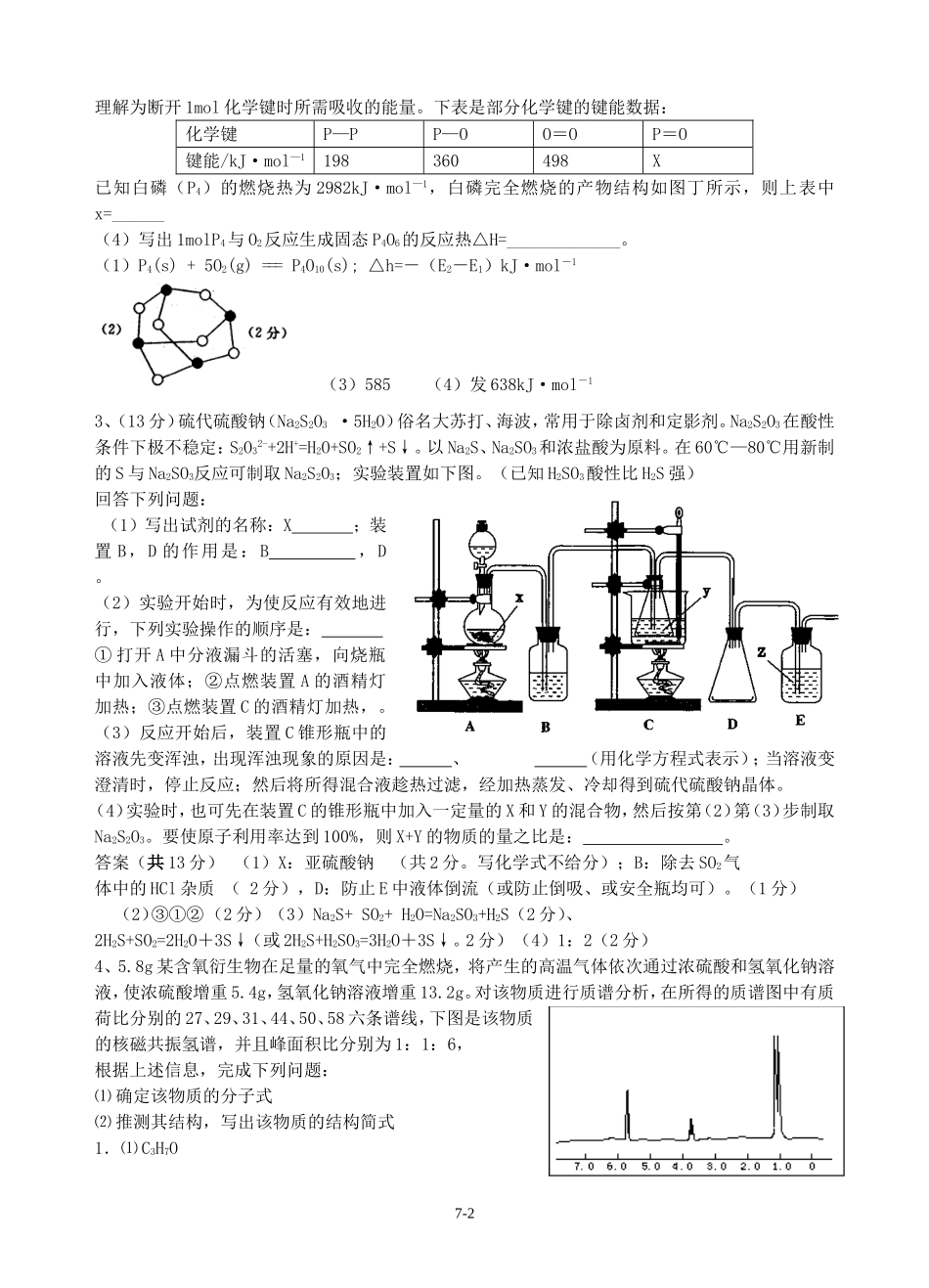
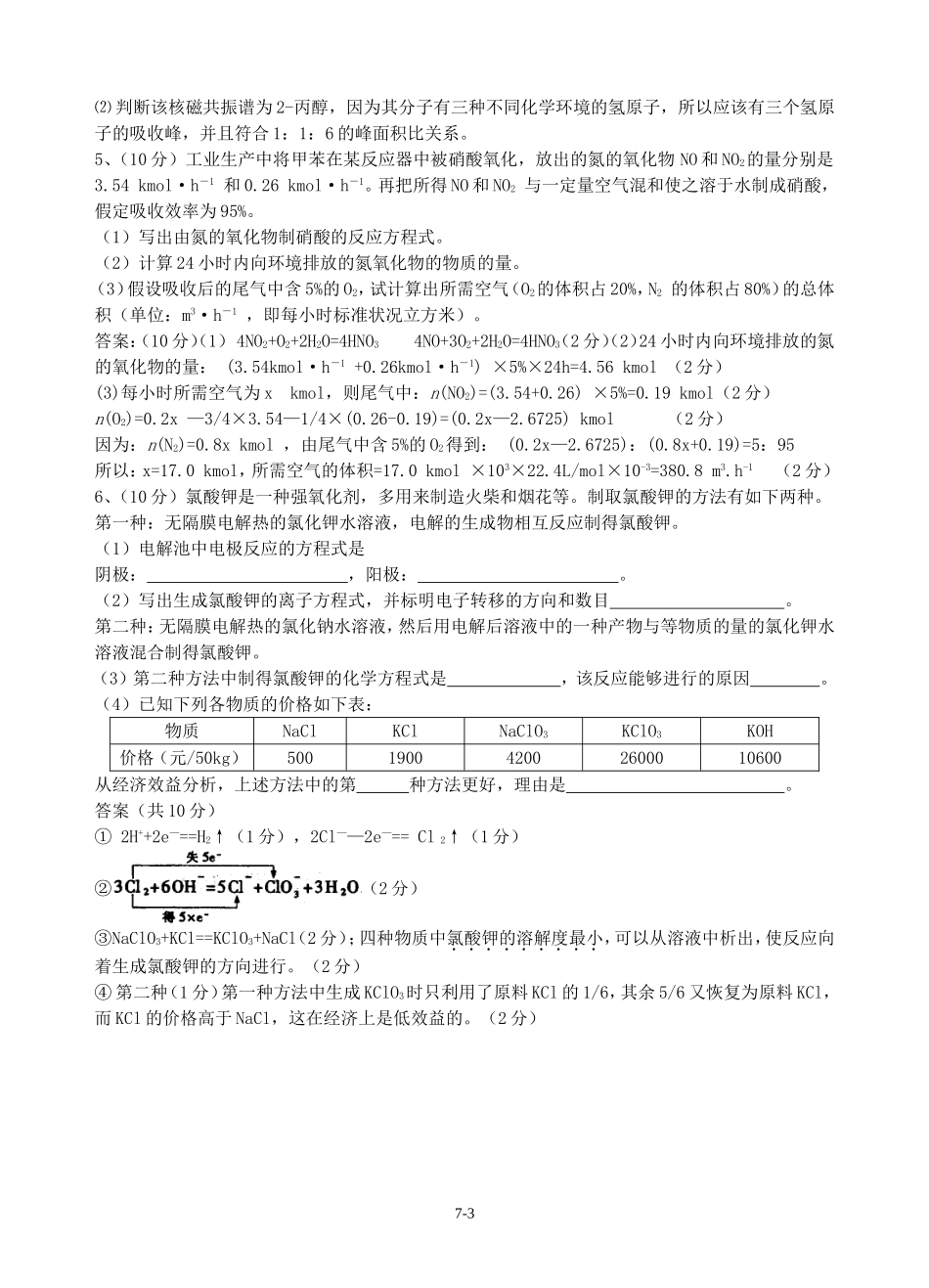
南师大第二附属高级中学高三化学二卷典型题训练七1、铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:⑴试剂1是,试剂2是,加入新制氯水后溶液中发生的离子反应方程式是,;⑵加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为,写出+2价Fe在空气中转化为+3价Fe的化学方程式;⑶该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?。若你认为合理,请说明理由(若你认为不合理,该空不要作答);若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)。答案:⑴稀盐酸KSCN溶液2Fe2++Cl2=2Fe3++2Cl-Fe3++SCN-=[Fe(SCN)]2+⑵少量的Fe2+转化为Fe3+,加入KSCN后显红色4Fe(OH)2+2H2O+O2=4Fe(OH)3⑶不合理我的猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)2、(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的7-1碾碎后加入试剂1静置,过滤药片一段时间后新制氯水试剂2淡黄色溶液淡红色溶液血红色溶液溶液褪色理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:化学键P—PP—OO=OP=O键能/kJ·mol—1198360498X已知白磷(P4)的燃烧热为2982kJ·mol—1,白磷完全燃烧的产物结构如图丁所示,则上表中x=______(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。(1)P4(s)+5O2(g)===P4O10(s);△h=-(E2-E1)kJ·mol-1(3)585(4)发638kJ·mol-13、(13分)硫代硫酸钠(Na2S2O3·5H2O)俗名大苏打、海波,常用于除卤剂和定影剂。Na2S2O3在酸性条件下极不稳定:S2O32-+2H+=H2O+SO2↑+S↓。以Na2S、Na2SO3和浓盐酸为原料。在60℃—80℃用新制的S与Na2SO3反应可制取Na2S2O3;实验装置如下图。(已知H2SO3酸性比H2S强)回答下列问题:(1)写出试剂的名称:X;装置B,D的作用是:B,D。(2)实验开始时,为使反应有效地进行,下列实验操作的顺序是:①打开A中分液漏斗的活塞,向烧瓶中加入液体;②点燃装置A的酒精灯加热;③点燃装置C的酒精灯加热,。(3)反应开始后,装置C锥形瓶中的溶液先变浑浊,出现浑浊现象的原因是:、(用化学方程式表示);当溶液变澄清时,停止反应;然后将所得混合液趁热过滤,经加热蒸发、冷却得到硫代硫酸钠晶体。(4)实验时,也可先在装置C的锥形瓶中加入一定量的X和Y的混合物,然后按第(2)第(3)步制取Na2S2O3。要使原子利用率达到100%,则X+Y的物质的量之比是:。答案(共13分)(1)X:亚硫酸钠(共2分。写化学式不给分);B:除去SO2气体中的HCl杂质(2分),D:防止E中液体倒流(或防止倒吸、或安全瓶均可)。(1分)(2)③①②(2分)(3)Na2S+SO2+H2O=Na2SO3+H2S(2分)、2H2S+SO2=2H2O+3S↓(或2H2S+H2SO3=3H2O+3S↓。2分)(4)1:2(2分)4、5.8g某含氧衍生物在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重5.4g,氢氧化钠溶液增重13.2g。对该物质进行质谱分析,在所得的质谱图中有...