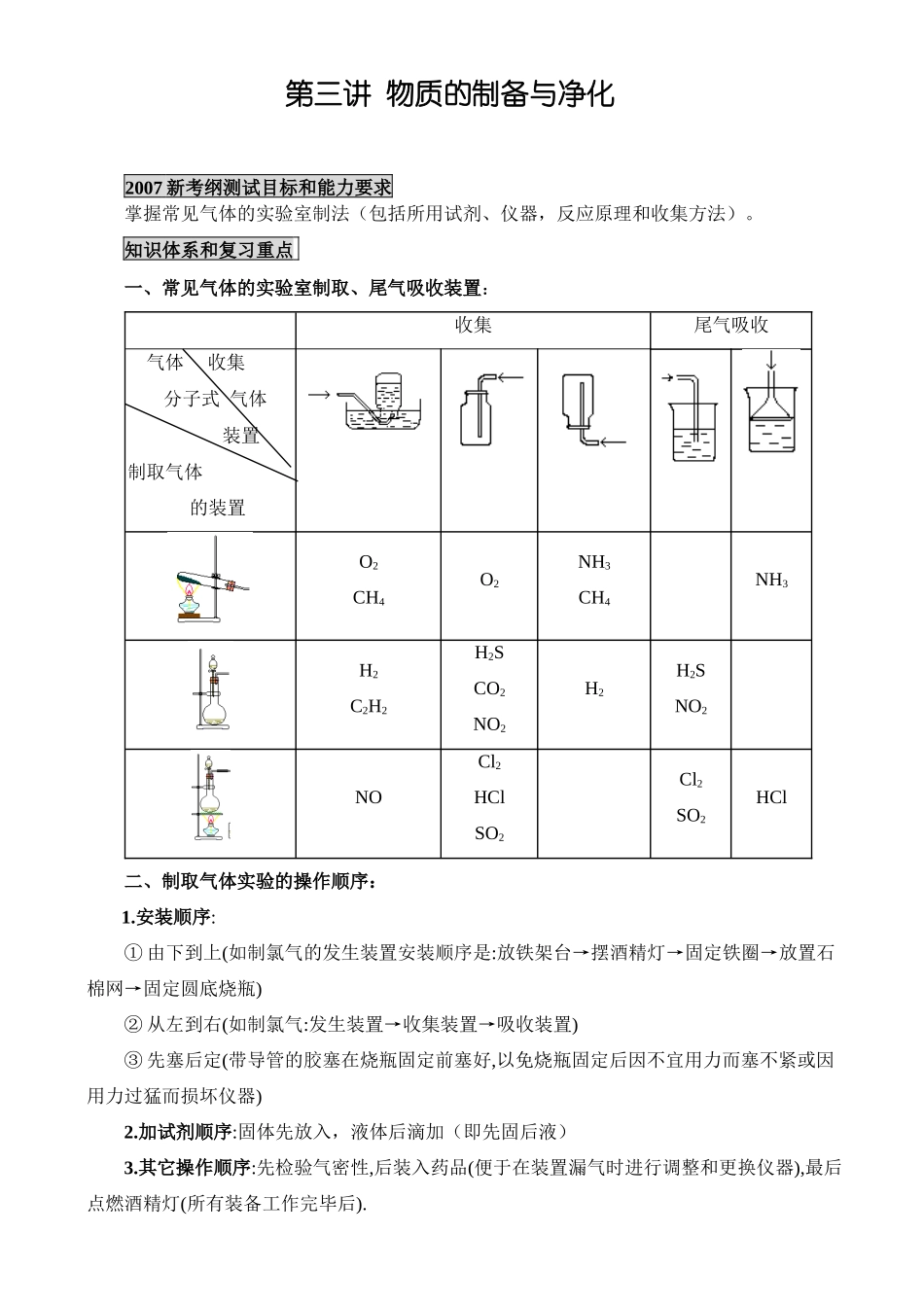
第三讲物质的制备与净化2007新考纲测试目标和能力要求掌握常见气体的实验室制法(包括所用试剂、仪器,反应原理和收集方法)。知识体系和复习重点一、常见气体的实验室制取、尾气吸收装置:收集尾气吸收气体收集分子式气体装置制取气体的装置O2CH4O2NH3CH4NH3H2C2H2H2SCO2NO2H2H2SNO2NOCl2HClSO2Cl2SO2HCl二、制取气体实验的操作顺序:1.安装顺序:①由下到上(如制氯气的发生装置安装顺序是:放铁架台→摆酒精灯→固定铁圈→放置石棉网→固定圆底烧瓶)②从左到右(如制氯气:发生装置→收集装置→吸收装置)③先塞后定(带导管的胶塞在烧瓶固定前塞好,以免烧瓶固定后因不宜用力而塞不紧或因用力过猛而损坏仪器)2.加试剂顺序:固体先放入,液体后滴加(即先固后液)3.其它操作顺序:先检验气密性,后装入药品(便于在装置漏气时进行调整和更换仪器),最后点燃酒精灯(所有装备工作完毕后).三、实验装置:一套完整的制备气体的实验装置应包括四个部分:发生装置→净化装置→收集装置→尾气处理①发生装置:选取的依据是制取所用的试剂的状态和反应条件(加热与否)。②净化装置:要根据反应物的性质及实验条件来分析可能含有的杂质,再根据主要成分与杂质性质上的差异选择除杂方案。一般净化气体时,除去水蒸气的干燥装置放在最后。用作干燥剂的物质须具备两个条件:一是本身要具有很强的吸水性,二是不能与被干燥的气体发生反应。实验室常用的干燥剂可划为三类:常见气体的干燥装置有两种:洗气瓶:可装液体干燥剂,如浓硫酸;干燥管:可装固体干燥剂气体洗涤装置液体洗涤剂固体洗涤剂③收集装置:选用收集方法的主要依据是气体的密度和水溶性。由氯气的物理性质得,用向上排空气法收集氯气,因氯气难溶于饱和食盐水,也可用排饱和食盐水收集.④尾气吸收处理装置:有三种:①用倒扣漏斗------极易溶于水的气体;②玻璃管----能溶于水或溶于溶液的气体的吸收(如用NaOH溶液吸收Cl2);③点燃法----处理CO。三、几种重要的无机物和有机物的制备:氢氧化铝、氢氧化亚铁、绿矾晶体、Fe(OH)3溶胶、溴乙烷、乙酸乙酯、肥皂、脲醛树脂等。几种重要无机物的制备:实验名称原理(化学方程式)现象及结论实验要点及注意事项备注Al(OH)3的实验室制法Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4白色胶状沉淀①Al3O4与水不作用②不宜用NaOH溶液代替氨水③Al(OH)3Al(OH)3为两性氢氧化物可溶于NaOH溶液中Fe(OH)3胶体的制备FeCl3+3H2OFe(OH)3(胶体)+3HCl所制胶体呈红褐色透明状①加热蒸馏水至沸腾②滴入适量饱和FeCl3溶液③边滴边振荡(不可搅拌)①可在FeSO4溶液中加入Fe屑以防Fe2+被氧化②也可在所取的FeSO4溶液中加适量苯,然后再滴人碱液Fe(OH)2的实验室制法FeSO4+2NaOH=Fe(OH)2↓+Na2SO4①先生成白色沉淀②振荡变灰绿色③最后变为红褐色①用煮沸过的蒸馏水配制有关溶液②将吸有NaOH溶液的胶头滴管尖端插入FeSO4溶液液面以下再滴加碱液银氨溶液的制备Ag++NH3·H2O=AgOH+NH4+AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O①先生成白色沉淀②继续滴加稀氨水沉淀消失①在洁净的试管中先加入适量2%的AgNO3溶液②逐滴滴入2%氨水③边滴边振荡直到沉淀刚好消失为止①银氨溶液必须随配随用,不可久置,否则会生成易爆炸的物质②剩余银氨溶液要及时倒掉或加酸处理四、制备物质的合理方案的选用原则:原理正确、步骤简单、原料易得、节省原料、易于分离提纯、污染少。如制备CuSO4.Cu(NO3)2.Al(OH)3等有多种方案,但最佳方案只有一种。温馨提示1.对气体制取、除杂、干燥、收集、转化要进行整体思考。2.气密性检查:可用加热法或水封法,不论哪种方法,事先都要确保系统是密封的。3.理解启普发生器使用条件,明确C2H2.SO2不能用该仪器制取。4.气体的收集:①因为C2H2.C2H4的气体密度很接近空气,所以不宜用向下排气法收集;②因为NO极易与空气中氧气反应生成NO2所以只能用排水法收集。5.对于NH3和HCl这2种污染性气体的尾气吸收装置要选用倒置的漏斗。6.克服思维定势:①除课本制气方法外,也可有其它方法。如用Na2O2和H2O、MnO2和H2O2制O2(装置同制C2H2);②了解制气装置替代方法,如用U形管或干燥管制CO2;③气...